
题目列表(包括答案和解析)
下列说法不正确的是
A.纤维素的葡萄糖单元中含有羟基
B.氨基酸分子中既有氨基,又有羧基,属于两性化合物
C.CH3CO18OH和C2H5OH发生酯化反应的有机产物是CH3CO18OC2H5
D.用甘氨酸(![]() )和丙氨酸(
)和丙氨酸(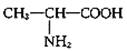 )缩合最多可形成4种二肽
)缩合最多可形成4种二肽
(15分)【化学——选修3:物质结构与性质】
Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2。
(1)与氮元素处于同一周期且相邻的两种元素分别是 ,这三种元素的第一电离能由大到小的顺序是 ,电负性由小到大的顺序是 。
(2)与NH3互为等电子体的分子、离子有 、 (各举一例)。
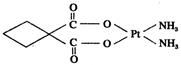
(3)碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物,其毒副作用低于顺铂。碳铂的结构如图:

碳铂分子中含有的作用力有 (填字母)。
A.极性共价键 B.非极性共价键 C.配位键 D.离子键
E.金属键 F. 键 G.
键 G. 键
键
(4)碳铂中C原子的杂化方式有 。
(5)铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

晶胞中铂(Pt)原子的配位数为 。若已知铂(Pt)的摩尔质量为M g/mol,阿伏加德罗常数为NA,Pt原子半径为b pm,则该晶胞的密度为 = g/cm3。(用含M、NA、b的计算式表示,不用化简)。
= g/cm3。(用含M、NA、b的计算式表示,不用化简)。
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子,B元素在周期表中的位置为 ,A2+在基态时外围电子(价电子)占据的能层符号为 ,外围电子(价电子)排布式 。
| A.极性共价键 | B.非极性共价键 | C.配位键 | D.离子键 |
 键 G.
键 G.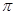 键
键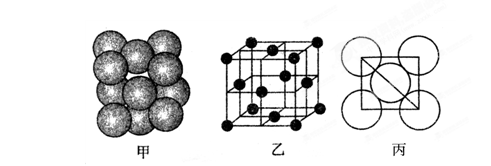
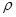 = g/cm3。(用含M、NA、b的计算式表示,不用化简)。
= g/cm3。(用含M、NA、b的计算式表示,不用化简)。(6分)某有机物X的化学式C12H16O3N2,某同学经过化学分析和仪器分析测定其结构,其过程如下:
(1)经实验,X既能与盐酸反应又能与氢氧化钠溶液反应。则X一定不可能属于的物质别 。
A.蛋白质 B.氨基酸 C.肽 D.硝基化合物
(2)光谱分析,X分子中含有一个苯环、一个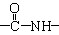 、一个
、一个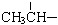 、一个
、一个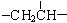 ,还有一个显碱性、一个显酸性的官能团。将该物质在一定条件下水解,能得到两种α—取代羧酸。其中一种的结构简式为:
,还有一个显碱性、一个显酸性的官能团。将该物质在一定条件下水解,能得到两种α—取代羧酸。其中一种的结构简式为: 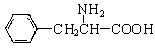 ,另一种水解产物结构简式为:
;
,另一种水解产物结构简式为:
;
(3)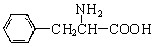 与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(
与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(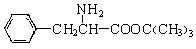 )和CH3OH,则醇X的结构简式为
。
)和CH3OH,则醇X的结构简式为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com