
题目列表(包括答案和解析)
(08年广东卷)下列化学反应的离子方程式正确的是( )
A.在稀氨水中通入过量CO2: NH3?H2O+CO2=NH![]() +HCO
+HCO![]()
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3![]() +2HClO
+2HClO
C.用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S![]()
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++![]() =CaSO4
=CaSO4![]() +H2O
+H2O
 (08广东实验中学三模)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如右图。试回答下列问题
(08广东实验中学三模)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如右图。试回答下列问题
(1)下列说法正确的是 (选填序号)。
A.砷化镓晶胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷和镓都属于p区元素
E.半导体GaP、SiC与砷化镓为等电子体
(2)砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到, 该反应在700℃进行,反应的方程式为: 。
AsH3空间形状为: (CH3)3Ga中碳镓键之间的键角为: 。
(3)Ga的核外电子排布式为: 。
(4)AsH3沸点比NH3低,其原因是: 。
(5)请预测AsH3的两种化学性质:
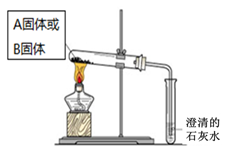
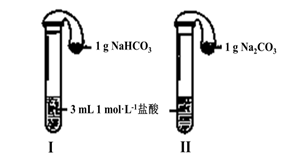
| 实验方案 | 预测现象 | 预测依据 | 实际结果 |
| 实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 | 有白色沉淀 |
| 实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 | 有白色沉淀出现,同时有少量气泡冒出。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com