
题目列表(包括答案和解析)
| A、质谱法是用高能粒子束轰击有机物分子,使之分离成带电的“碎片”,并根据其特征谱分析有机物结构的方法 | B、丁达尔现象可用于区别溶液与胶体,云、雾、稀硫酸均能产生丁达尔现象 | C、谷氨酸(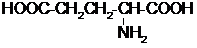 )的熔点高达205℃,难溶于苯等有机溶剂,主要是因为形成内盐 )的熔点高达205℃,难溶于苯等有机溶剂,主要是因为形成内盐 | D、“地沟油”经过加工处理制得肥皂或生物柴油,可以实现厨余废物合理利用. |
| A.将Fe(OH)3粉末溶于水中可得Fe(OH)3胶体 |
| B.电泳现象可证明胶体属于电解质溶液 |
| C.利用丁达尔效应可以区别溶液与胶体 |
| D.胶体粒子很小,可以透过半透膜 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com