
题目列表(包括答案和解析)
| 1 | 10 |
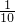 置于锥形瓶中,用0.05mol?L-1标准碘溶液进行滴定,消耗标准碘溶液20.00mL.请回答下列问题:
置于锥形瓶中,用0.05mol?L-1标准碘溶液进行滴定,消耗标准碘溶液20.00mL.请回答下列问题: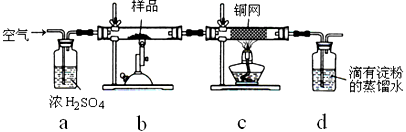
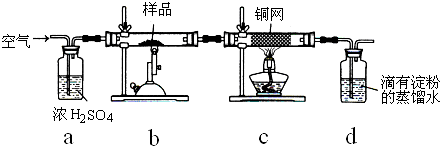
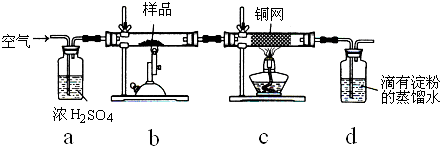
(17分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
称取研细的黄铜矿样品1.150g,在空气存在的条件下进行煅烧。实验后取d中溶液的1/10置于锥形瓶中,用0.05mo1/L标准碘溶液进行滴定,初读数为0.10mL,终读数如右上图所示。
(1)黄铜矿煅烧的反应为8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2,该反应中被还原的元素是___(填元素符号)。
(2)标准碘溶液应盛放在(填“碱式”或“酸式”)________滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是: 。请用化学方程式表示滴定的原理: 。
(3)滴定终点的读数为 mL;通过计算可知,该黄铜矿的纯度为 。
(4)若去掉c装置,会使测定结果 (填“偏低”“偏高”或“无影响”)。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,可能的原因主要有 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com