A、B、C、D、E是原子序数依次增大的五种短周期元素.其中D原子最外层电子数是内层电子总数的3倍;D、E同族;A与D、E既不同族也不同周期;B元素的某种同位素原子在考古方面有重要应用.
(1)E的离子结构示意图为
.
(2)钠、A和D三种元素组成化合物的电子式
.(或化学键
离子键、共价键
离子键、共价键
)
(3)A、D两种元素组成的含有18电子的分子甲常温下甲是一种无色液体.甲的水溶液呈现弱酸性,写出其电离方程式:
H
2O
2
H
++HO
2ˉ
H
2O
2
H
++HO
2ˉ
.
(4)A、C以1:2组成的共价分子乙也含有18电子,在碱性溶液中能够将CuO还原为Cu
2O,已知每1mol乙参加反应有 4mol电子转移,该反应的化学方程式为:
N2H4+4CuO=N2↑+2Cu2O+2H2O
N2H4+4CuO=N2↑+2Cu2O+2H2O
.
(5)处理含BD、ED
2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质E.已知反应生成1g E固体单质时放出8.4kJ热量,此反应的热化学方程式为
2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8kJ?molˉ1
2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8kJ?molˉ1
.
(6)将0.500mol ED
2(g)和0.300mol D
2(g)放入容积为10L的密闭容器中,反应:D
2(g)+2ED
2(g)?2ED
3(g)在一定条件下达到平衡.①写出反应的平衡常数表达式K=
②平衡时测得c(D
2)=0.10 0mol?Lˉ
1,二氧化硫的平衡转化率为
80%
80%
.







 HClO+OH-
HClO+OH- HClO+OH-
HClO+OH-







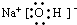
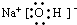
 H++HO2ˉ
H++HO2ˉ H++HO2ˉ
H++HO2ˉ