
题目列表(包括答案和解析)


为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;
反应过程中不考虑水和氯化氢的挥发。
[设计方案]
(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
[进行实验]
甲组同学:称取12.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水。过滤、洗涤、干燥,共得到白色沉淀10.00g。
乙组同学:称取12.00g样品,加入足量的稀盐酸直到反应停止,共收集到4.40g二氧化碳。
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数。(计算结果精确到0.1% )
解:_______________________________________________
答:_______________________________________________
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质________(填一种具体物质)的溶液与样品反应,通过测定相关物质的质量,进行有关计算即可。
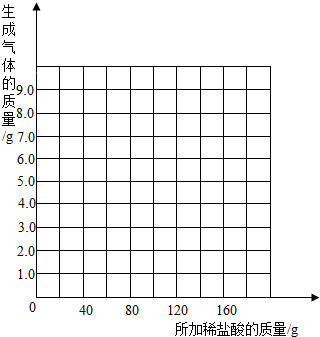
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取18.45g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
| 加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.90 | 97.80 | 116.70 | 135.60 | 155.05 | 175.05 | 195.05 |
分析表中实验数据的变化规律,获取反应生成气体的质量,通过有关计算,即可求出稀盐酸的溶质质量分数。
问题:请你在右边的坐标纸上绘制生成气体的质量与所加稀盐酸质量关系的曲线。

为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;
反应过程中不考虑水和氯化氢的挥发.
[设计方案]
(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
[进行实验]
甲组同学:称取12.00 g样品,加水配成溶液,在溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀10.00 g.
乙组同学:称取12.00 g样品,加入足量的稀盐酸直到反应停止,共收集到4.40 g二氧化碳.
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数.(计算结果精确到0.1%)
解:__________________________
答:__________________________
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质________(填一种具体物质)的溶液与样品反应,通过测定相关物质的质量,进行有关计算即可.
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取18.45 g样品放入烧杯中,每次加入20 g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
分析表中实验数据的变化规律,获取反应生成气体的质量,通过有关计算,即可求出稀盐酸的溶质质量分数.
问题:请你在下边的坐标纸上绘制生成气体的质量与所加稀盐酸质量关系的曲线.

 为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:| 加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.90 | 97.80 | 116.70 | 135.60 | 155.05 | 175.05 | 195.05 |
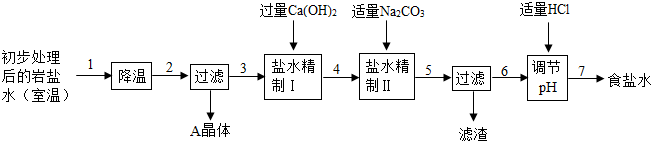
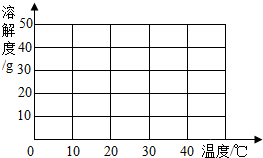 某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品.
某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品.| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 | 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| 解 | 硫酸钠 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 |
| 度 | 氯化钙 | 59.5 | 65.0 | 74.5 | 100 | 116 |
| /g | 氯化镁 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 |
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 盐酸的质量 | 25 | 25 | 25 | 25 |
| 烧杯及所盛物质总质量 | 180.3 | 202.6 | 226.4 | 251.4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com