
题目列表(包括答案和解析)

| 催化剂 |
| △ |
| 催化剂 |
| △ |
 2CH3CHO+2H2O
2CH3CHO+2H2O 2CH3CHO+2H2O
2CH3CHO+2H2O
(10分)利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
I、B与醋酸反应: ▲ , ▲ 反应。
II、B→C: ▲ , ▲ 反应。
(2) 可用于检验A的试剂是 ▲ 。
(3)用淀粉[(C6H10O5)n]为原料制取B,若有含淀粉40%的植物果实1kg,经反应制得184g的B,则淀粉的转化率为 ▲ 。(提示:转化率=已反应的量/原有的量×100%)
Ⅰ.甲醇是一种新型的能源。
(1)合成气(组成为H2和CO)是生产甲醇的重要原料,请写出由焦炭和水在高温下制取合成气的化学方程式 。
(2)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在容积为l L的密闭容器中,由CO和H2合成甲醇。在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);

下列说法正确的是 (填序号)
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= (mol·L-1·min-1)
(mol·L-1·min-1)
B.该反应在T1时的平衡常数比T2时的大
C.该反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时 减小
减小
(4)在T1温度时,将1 mol CO和2mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO转化率为a,则容器内的压强与起始压强之比为 ;
(5)在直接以甲醇为燃料的电池中,电解质溶液为碱性,负极的反应式为 ;假设原电解质为NaOH,且电池工作一段时间后溶质只有Na2CO3,此时溶液中各离子浓度大小关系为
Ⅱ.已知Ksp(AgCl)=1.56×10-10 ,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有C1-, Br-和CrO42-,浓度均为0.010mo1·L-1,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 。
化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是__________________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为_________、___________。
(3)某化肥厂用NH3制备NH4NO3,已知由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去NH3的质量占耗用全部NH3质量的__________%。
(4)合成氨气是生产氮肥的重要环节。合成氨生产简易流程示意图如下:
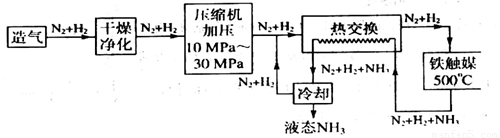
从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作___________。合成氨的反应需在500℃进行,其主要原因是_________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com