
题目列表(包括答案和解析)
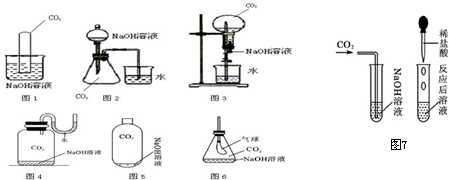
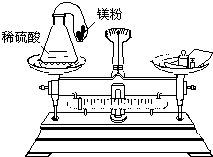 化学反应的实质是原子的重新组合.那么,在一切化学反应前后,物质的总质量是否发生变化呢?针对这一问题,甲、乙、丙三位同学分别做了如下实验探究:
化学反应的实质是原子的重新组合.那么,在一切化学反应前后,物质的总质量是否发生变化呢?针对这一问题,甲、乙、丙三位同学分别做了如下实验探究:| 砝码 | 100g | 50g | 20g | 20g | 10g | 5g |
| 使用情况 | ↓ | ↓↑ ↓↑ |
↓ ↓ |
↓↑ | ↓ ↓ |
↓ |
| 实验 | 实验步骤 | 实验现象 | 燃烧反应的化学方程式 |
| A | ①硫在空气中燃烧 | ①发出淡蓝色火焰并产生有刺激味气体 | ________ |
| ②硫在氧气中燃烧 | ②________并产生有刺激味气体 | ||
| B | ③铁在空气中燃烧 | ③无法点燃 | ________ |
| ④铁在氧气中燃烧 | ④________并生成黑色固体 |
| 化学反应的程度与反应物的浓度之间有一定的规律可循.某实验小组各取等质量的木炭和等质量的硫分别在容积相同的集气瓶中燃烧. (1)记录如下:②木炭在氧气中燃烧比在空气中燃烧更旺,发出白光,放出更多的热量.木炭燃烧的化学方程式为:___________.④硫在氧气中燃烧发出明亮的蓝紫色火焰,放出更多的热量.硫燃烧的化学方程式为:___________. | |||||||||||||||||||
|
(2)
| |||||||||||||||||||
| (3)通过A、B两组对比实验的现象,可以得出的规律是: ____________________ | |||||||||||||||||||

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com