
题目列表(包括答案和解析)
 ”和“
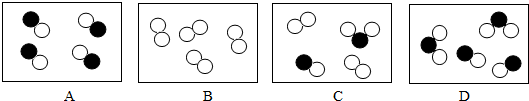
”和“ ”分别表示质子数不同的两种原子,则下列图中表示化合物的是______.(填字母)
”分别表示质子数不同的两种原子,则下列图中表示化合物的是______.(填字母)


 ”和“
”和“ ”分别表示质子数不同的两种原子,则下列图中表示化合物的是 .(填字母)
”分别表示质子数不同的两种原子,则下列图中表示化合物的是 .(填字母)
(1)在H、C、O、Na、Fe、Cl几种元素中,选择适当元素组成符合下列要求的物质,将其化学式填在下面相应横线上.
①遇到干旱时节,可用于人工降雨的干冰 ;
②厨房中常备,可用作调味剂的是 ;
③天然气的主要成分 ;
④可用来冶炼铁的赤铁矿的主要成分是 .
(2)学好化学,必须要熟悉物质的组成与分类.图中“ ”和“
”和“ ”分别表示质子数不同的两种原子,则下列图中表示化合物的是 .(填字母)
”分别表示质子数不同的两种原子,则下列图中表示化合物的是 .(填字母)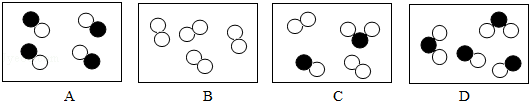
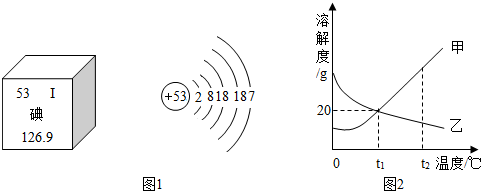
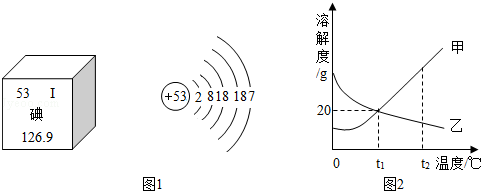
(3)随着日本福岛核电站放射性碘泄漏,碘这种元素被人们所关注.图1是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.
由此可知,下列说法错误的是 .(填字母)
A.碘原子的核电荷数为53
B.碘原子核外有五个电子层,在化学反应中容易失去电子
C.碘属于非金属元素
D.碘的相对原子质量为126.9
(4)甲、乙两固体物质的溶解度曲线如图2所示,下列说法正确的是 .(填字母,可能有多个选项)
A.随着温度的升高,甲的溶解度增大,乙的溶解度减小
B.t1℃时,30g甲加入到50g水中最多可得80g溶液
C.t2℃,等质量的甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液质量的大小关系为:甲<乙
D.t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:甲>乙.
(1)在H、C、O、Na、Fe、Cl几种元素中,选择适当元素组成符合下列要求的物质,将其化学式填在下面相应横线上.
①遇到干旱时节,可用于人工降雨的干冰 ;
②厨房中常备,可用作调味剂的是 ;
③天然气的主要成分 ;
④可用来冶炼铁的赤铁矿的主要成分是 .
(2)学好化学,必须要熟悉物质的组成与分类.图中“ ”和“
”和“ ”分别表示质子数不同的两种原子,则下列图中表示化合物的是 .(填字母)
”分别表示质子数不同的两种原子,则下列图中表示化合物的是 .(填字母)

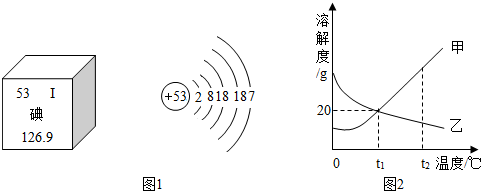
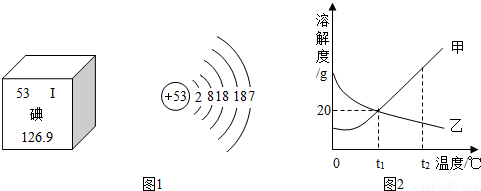
(3)随着日本福岛核电站放射性碘泄漏,碘这种元素被人们所关注.图1是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.
由此可知,下列说法错误的是 .(填字母)
A.碘原子的核电荷数为53
B.碘原子核外有五个电子层,在化学反应中容易失去电子
C.碘属于非金属元素
D.碘的相对原子质量为126.9
(4)甲、乙两固体物质的溶解度曲线如图2所示,下列说法正确的是 .(填字母,可能有多个选项)
A.随着温度的升高,甲的溶解度增大,乙的溶解度减小
B.t1℃时,30g甲加入到50g水中最多可得80g溶液
C.t2℃,等质量的甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液质量的大小关系为:甲<乙
D.t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:甲>乙.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com