二甲醚(CH
3OCH
3)被称为21世纪的新型能源,是一种高效、清洁能源.
Ⅰ.工业制备二甲醚的生产流程如下:
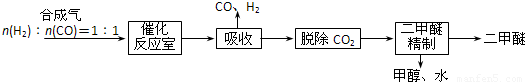
催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H
2(g)?CH
3OH(g)△H=-90.7kJ/mol
②2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)△H=-23.5kJ/mol
③CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO
2合成制得,该反应的化学方程式为______.
(2)催化反应室中总反应3CO(g)+3H
2(g)?CH
3OCH
3(g)+CO
2(g)的△H=______,830℃时反应③的K=1.0,则在催化反应室中反应③的K______1.0(填“>”、“<”或“=”).
(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
下列说法正确的是______.(填字母序号)
A.a+2c=23.5 B.α
1+α
2=1 C.V
1>V
3 D.c
1=2c
3(4)上述生产流程中,可以循环使用的物质有______.
Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.
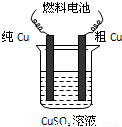
(5)请写出燃料电池中的负极反应式:______.
(6)燃料电池正极消耗标准状况下空气的体积是______(空气中O
2体积分数以20%计算).




