
题目列表(包括答案和解析)
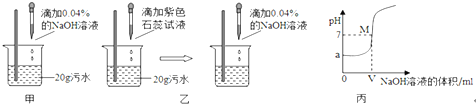
| 实验方法 | 现象和结论 |
| 现象: 结论:猜想二不成立 |
| 实验方法 | 观察到的现象 |
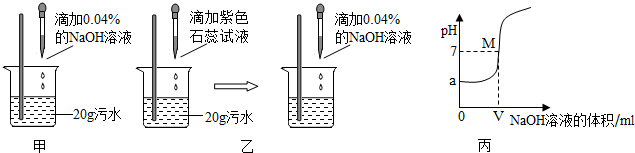
甲、乙、丙、丁四位同学在探究碱与酚酞溶液反应的实验时,发现了一个意外现象:将氢氧化钠溶液滴入酚酞溶液中,溶液变成了红色,可是过了一会儿红色就消失了.这是什么原因呢?他们依据所学的化学知识,分别对这种意外现象的原因作了如下猜想:
甲:可能是酚酞变质造成的.
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故.
丙:可能是酚酞与氧气反应,使红色消失.
丁:可能与氢氧化钠溶液浓度大小有关.
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是:________________.
(2)丙同学根据查得的资料:碳酸钠水溶液显碱性.认为乙同学的猜想________.
(3)四位同学讨论后认为要验证丙同学的猜想,还需做如下实验,你知道其实验的目的吗?

通过以上实验,四位同学观察到的现象是:溶液先变成红色,过了一会儿红色仍然消失.
(4)若丁同学的猜想正确,大家能设计实验证明吗?请说出实验的方法和结论.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com