
题目列表(包括答案和解析)
化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g) 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)。
① v(A)=3v(B) ②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填 “a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1________m2(选填“<”、“=”或“>”)。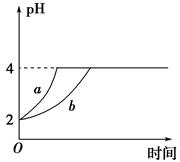
(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1______V2(填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g) 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)。
① v(A)=3v(B) ②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填 “a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1________m2(选填“<”、“=”或“>”)。

(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1______V2(填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是
(2)根据表中数据判断,浓度均为0.01 mol/L 的下列五种物质的溶液中,酸性最强的是_______ (填编号) ; 将各溶液分别稀释100倍, pH变化最小的是 (填编号) 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
(3)据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5 ONa=Na2CO3+2C6H5OH
Ⅳ、已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2 (氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
SOCl2的作用是___________________________________。
化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g)![]() 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填
序号)。
① v(A)=3v(B) ②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1________m2(选填“<”、“=”或“>”)。


(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1______V2(填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是
(2)根据表中数据判断,浓度均为0.01 mol/L 的下列五种物质的溶液中,酸性最强的是_______ (填编号) ; 将各溶液分别稀释100倍, pH变化最小的是 (填编号) 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
(3)据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
Ⅳ、已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2 (氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
SOCl2的作用是___________________________________。

某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-=2Fe2++SO42-+2H+;二是发生双水解反应:
2Fe2++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了弄清是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ 实验用品Na2SO3浓溶液、BaC12稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,实验者设计这个实验目的是 。
实验Ⅱ 取5mL FeC13浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色物质是 。向红褐色物质中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为 。另一份加入BaC12稀溶液,有少量白色沉淀的离子方程式是 。
实验Ⅲ 换用稀释FeC13和Na2SO3溶液重复实验Ⅱ,产生的现象完全相同。由上述实验得出的结论是 。若FeC13浓溶液中加入Na2CO3浓溶液,观察到产生红褐色沉淀和无色气体,该反应的离子反应方程式是 。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,两者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:① ;② 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com