某兴趣小组同学对实验室制备氧气的若干问题进行如下实验探究.
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲同学设计以下对比实验:
Ⅰ.将2.45g KClO
3与1.0g MnO
2均匀混合加热
Ⅱ.将 x g KClO
3与1.0g CuO均匀混合加热
在相同温度下,比较两组实验产生O
2的快慢.通常采用的方法有:
①测相同时间内产生O
2的体积
②测
收集相同体积O2所需的时间
收集相同体积O2所需的时间
;
Ⅰ中反应的文字表达式是
;
Ⅱ中x的值应为
2.45
2.45
.
(2)乙同学探究了影响双氧水分解速度的某种因素,实验数据记录如表:
| |
双氧水的质量 |
双氧水的浓度 |
MnO2的质量 |
相同时间内产生O2的体积 |
| I |
50.0g |
1% |
0.1g |
9mL |
| II |
50.0g |
2% |
0.1g |
16mL |
| III |
50.0g |
4% |
0.1g |
31mL |
【数据处理及结论】
I.本实验中,测量O
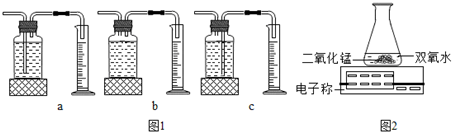
2体积的装置是
c
c
(选填图1中“a”“b”“c”编号).
II.实验结论:在相同条件下,
双氧水浓度越大
双氧水浓度越大
,双氧水分解速率越快.
III.丙用如图2装置进行实验,通过比较
相同时间天平读数差值大小(或电子称上示数减小的速度)
相同时间天平读数差值大小(或电子称上示数减小的速度)
也能达到实验目的.
(3)丙同学用KClO
3和MnO
2的混合物制取O
2,完全反应后的固体残渣,经以下四步实验操作,回收得到了较纯净的MnO
2(残渣中只有MnO
2难于水).
他的正确操作先后顺序是
bcda
bcda
(填写选项符号).
a.烘干 b.溶解 c.过滤 d.洗涤
步骤 c需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、
玻璃棒
玻璃棒
,所填仪器在过滤操作中的作用是
引流
引流
.
(4)丁同学在学习了质量守恒定律后,尝试计算了甲同学的实验中2.45g KClO
3完全分解后生成O
2的质量为
0.96
0.96
g,标准状况下的O
2体积为
671.8
671.8
mL.(已知标准状况下,氧气密度为1.429g/L,结果精确到0.1mL)(无需写计算过程)