
题目列表(包括答案和解析)
(12分)
A.下图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
|
| |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表
的 区。
(2)②、⑥两元素形成的化合物的空间构型为 ,其中心原子的杂化类型为 。
(3)写出元素⑧基态原子的电子排布式 。
(4)①③两元素形成的最简单的化合物与 (写微粒符号)互为等电子体。
(5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于___ 晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力
为 。
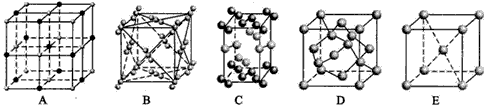
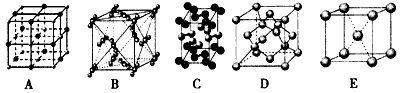
(7) 金属⑦的晶体在不同温度下有两种堆积方式,晶胞分 别如右图所示。 则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
B.(12分)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇
2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g)①,25℃时, K=2.95×1011
CH3CH2OH(g)+3H2O(g)①,25℃时, K=2.95×1011
2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g)②,25℃时, K=1.71×1022
CH3CH2OH(g)+H2O(g)②,25℃时, K=1.71×1022
(1)写出反应①的平衡常数表达式K=__________________。
(2)条件相同时,反应①与反应②相比,转化程度更大的是________。以CO2为原料合成乙醇的优点是 (写出一条即可)。
 |
根据表中数据分析:
①温度升高,K值______(填“增大”、“减小”或“不变”)。
②提高氢碳比[ n(H2)/n(CO2)],对生成乙醇 (填“有利”、“不利”)。
 (4)在下图的坐标中作图说明压强变化对反应①的化学平衡的影响。(必须在图中标明坐标轴所表示的物理量。
(4)在下图的坐标中作图说明压强变化对反应①的化学平衡的影响。(必须在图中标明坐标轴所表示的物理量。
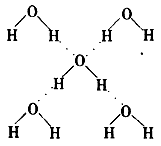
“氢原子失去电子后,剩余1个质子构成的核,即氢离子。氢离子是'裸露'的质子,半径很小,易被水分子吸引生成水合氢离子,通常用H3O+表示。”下列是某同学对这段文字的理解:
①氢离子都是裸露的质子;
②11H失去电子变成裸露的质子;
③1mol H3O+含有6.02×1024个电子;
④电子数相等、原子总数相等的微粒互称为等电子体,等电子体的结构和性质相似,由此可推知H3O+呈正三角形;
⑤H3O+含极性共价键,不含非极性共价键。
其中不正确的是
(15分)氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)  CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。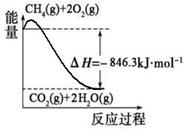

(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO] (l)+CO(g)+NH3(g)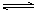 [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0
某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为_________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。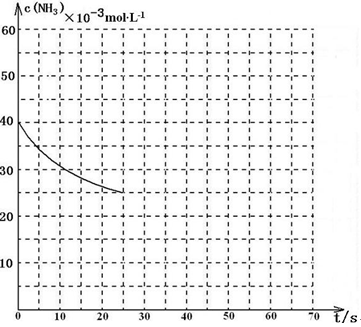
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com