
题目列表(包括答案和解析)
氮元素的化合价态较多,负价态氮与正价态氮之间发生氧化还原反应时会有氮气生成.下面介绍的甲、乙两位学生设计的两种制备少量氮气的不同实验方案的示意框图(箭头表示气体流向).

试回答下列问题:
(1)甲、乙两位学生的实验方案是否能制得氮气?
甲________,乙________.(填“能”或“不能”)
(2)若不能制得氮气,请具体说明原因,并指出纠正的办法.(如两种方案都能制得氮气,此小题不要回答)
(3)甲方案中所用的碱石灰是否可换成浓硫酸?请说明理由.
(4)甲、乙两位同学若按正确操作制得氮气,在相同条件下,用密度法测出的氮气相对分子质量为Mr(精确到0.001),若进行比较,有Mr(甲)________Mr(乙).(填“大于”、“等于”或“小于”)
氮元素的化合价态较多,负价态氮与正价态氮之间发生氧化还原反应时会有氮气生成.下面介绍的甲、乙两位学生设计的两种制备少量氮气的不同实验方案的示意框图(箭头表示气体流向).试回答下列问题:
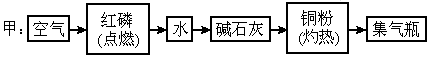

(1)甲、乙两位学生的实验方案是否能制得氮气?甲________、乙______(填“能”或“不能”)
(2)若不能制得氮气,请具体说明原因,并指出纠正的办法(如两种方案都能制得氮气,此小题不要回答).
(3)甲方案中所用的碱石灰是否可换成浓硫酸?请说明理由.
(4)甲、乙两位同学若按正确操作制得氮气,在相同条件下,用密度法测出的氮气相对分子质量为材Mr(精确到0.001),若进行比较,有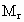 (甲)________
(甲)________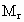 (乙)(填“大于”、“等于”或“小于”).
(乙)(填“大于”、“等于”或“小于”).
氮元素的化合价态较多,负价态氮与正价态氮之间发生氧化还原反应时会有氮气生成.下面介绍的甲、乙两位学生设计的两种制备少量氮气的不同实验方案的示意框图(箭头表示气体流向).试回答下列问题:


(1)甲、乙两位学生的实验方案是否能制得氮气?甲________、乙______(填“能”或“不能”)
(2)若不能制得氮气,请具体说明原因,并指出纠正的办法(如两种方案都能制得氮气,此小题不要回答).
(3)甲方案中所用的碱石灰是否可换成浓硫酸?请说明理由.
(4)甲、乙两位同学若按正确操作制得氮气,在相同条件下,用密度法测出的氮气相对分子质量为材Mr(精确到0.001),若进行比较,有 (甲)________
(甲)________ (乙)(填“大于”、“等于”或“小于”).
(乙)(填“大于”、“等于”或“小于”).
| 族 周期 |
IA | 0 | ||||||
| 1 | H | IIA | IIIA | IVA | VA | VIA | VIIA | He |
| 2 | Li | Be | B | C | N | O | F | Ne |
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar |




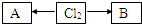 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com