
题目列表(包括答案和解析)
(16分)碳及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+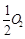 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ①
C(s)+O2(g)=CO2(g) ΔH2= -393.5kJ·mol-1 ②
S(s)+O2(g)=SO2(g) ΔH3= -296.8kJ·mol-1 ③
则SO2氧化CO的热化学反应方程式:
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。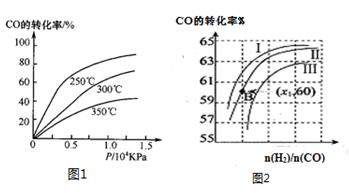
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH 0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为 ;测得B(X1,60)点氢气的转化率为40%,则x1= 。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 (填序号)。
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
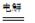 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。
2005年江苏酸雨污染有所加重,酸雨发生频率为34.1%,上升了6.2个百分点,每三场雨中就有一场多是酸雨。某校研究性学习小组拟对本市空气中二氧化硫含量(![]() )进行测定。经查阅资料可采用以下方法:
)进行测定。经查阅资料可采用以下方法:
实验原理:大气中的二氧化硫用甲醛溶液吸收后,生成稳定的羟甲基磺酸加成化合物,再加入氢氧化钠使加成化合物分解,释放出二氧化硫,与副玫瑰苯胺、甲醛作用,生成紫红色化合物。据其颜色深浅,用分光光度计在577nm处进行测定。
分光光度计是利用分光光度法对物质进行定量、定性分析的仪器。而分光光度法则是通过测定被测物质在特定波长时光的吸收度,对该物质进行定性和定量分析。其工作原理可以简单地用公式表示为![]() ,其中A为吸光度,K为一定条件下的常数,c为溶液浓度。
,其中A为吸光度,K为一定条件下的常数,c为溶液浓度。

实验步骤:
(1)采样:
①若你是该兴趣小组成员,你对采样的地点和时间有何建议:
②用图装置采样。通过50L空气后,将吸收液移入100mL容量瓶,用少量吸收液分两次洗涤吸收装置,合并洗涤液于容量瓶中,定容备用。用多孔球泡而不用导管的原因是
(2)吸光度与![]() 含量标准曲线的绘制:在6支25mL比色管中,用每毫升含25
含量标准曲线的绘制:在6支25mL比色管中,用每毫升含25![]() 二氧化硫的标准液配置下表中的标准
二氧化硫的标准液配置下表中的标准![]() 含量系列。
含量系列。
二氧化硫标准系列
| 管号 | 0 | 1 | 2 | 3 | 4 | b |
| 标准液/mL | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
| 吸收液/mL | 10.00 | 9.80 | 9.60 | 9.40 | 9.20 | 9.00 |
| 二氧化硫含量/ | 0 | 5.00 | 10.00 | 15.00 | 20.00 | 25.00 |
用10mL比色皿,以水为参比,测定各管吸光度,实验结果如下。
| 管 号 | 0 | 1 | 2 | 3 | 4 | 5 |
| 吸光度 | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
以吸光度值为纵坐标,二氧化硫含量(![]() )为横坐标,绘制标准曲线。
)为横坐标,绘制标准曲线。
(3)准确量取容量瓶中溶液10mL加人比色皿,测得其吸光度值为0.24,则空气中二氧化硫含量为 ![]() 。我国环境空气质量标准中对每次空气质量测定中
。我国环境空气质量标准中对每次空气质量测定中![]() 的最高浓度限值(m9/m3):一级标准:0.15,二级标准:0.50,三级标准:0.70。则该市空气为 级标准。
的最高浓度限值(m9/m3):一级标准:0.15,二级标准:0.50,三级标准:0.70。则该市空气为 级标准。
(4)甲、乙两组同学测定结果相差较大,试分析乙组同学测定空气中![]() 含量偏小的可能原因:(两个所用药品和装置均无问题)
含量偏小的可能原因:(两个所用药品和装置均无问题)
(5)请你提出江苏防治酸雨的两条主要措施:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com