
题目列表(包括答案和解析)
(16分)生物质资源是一种污染小的可再生能源。生物质的主
(1)下列有关说法正确的是 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g)CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO 、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
下列说法正确的是 。
a. c1 = c2 b. 2Q1 = Q3 c. K1=K3 d. α2+ α3< 100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)= mol。
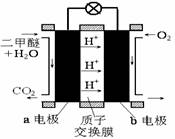
②右图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。
b电极是 极;a电极的反应式为 。
(16分)生物质资源是一种污染小的可再生能源。生物质的主
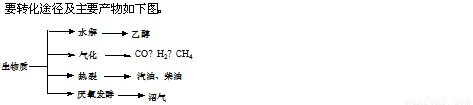
(1)下列有关说法正确的是 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1molCO 、2molH2 |
1mol CH3OH |
2molCO、4molH2 |
|
CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
|
平衡常数 |
K1 |
K2 |
K3 |
|
反应物转化率 |
α 1 |
α 2 |
α 3 |
下列说法正确的是 。
a. c1 = c2 b. 2Q1 = Q3 c. K1=K3 d. α2+ α3< 100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g)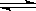 CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)= mol。
②右图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。
b电极是 极;a电极的反应式为 。
生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如下图.

(1)下列有关说法正确的是________.
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质.当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是________.
a.汽油
b.甲醇
c.甲醛
d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.8 kJ·mol-1.
CH3OH(g) ΔH=-90.8 kJ·mol-1.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:

下列说法正确的是________.
a.c1=c2
b.2Q1=Q3
c.K1=K3
d.α2+α3<100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍.则:①反应开始时正、逆反应速率的大小:v(正)________v(逆)(填“>”、“<”或“=”),理由是________.平衡时n(CH3OCH3)=________mol.
②下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图.

b电极是________极;
a电极的反应式为________.
(14分)生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。
(1)下列有关说法正确的是 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应: CO(g)+2H2(g)CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO 、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
下列说法正确的是 。
a. c1 = c2 b. 2Q1 = Q3 c. K1=K3 d. α2+ α3< 100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)= mol。
②下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。
b电极是 极;a电极的反应式为 。
(14分)生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。

(1)下列有关说法正确的是 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应: CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1molCO 、2molH2 |
1mol CH3OH |
2molCO、4molH2 |
|
CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
|
平衡常数 |
K1 |
K2 |
K3 |
|
反应物转化率 |
α 1 |
α 2 |
α 3 |
下列说法正确的是 。
a. c1 = c2 b. 2Q1 = Q3 c. K1=K3 d. α2+ α3< 100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)= mol。
②下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。

b电极是 极;a电极的反应式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com