26、元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1~18号元素的原子结构示意图.我对它进行研究:
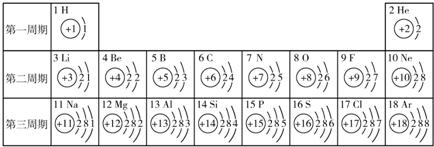
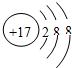
(1)原子序数为17的元素名称是
氯
,在化学反应中,该元素的原子容易(填“得”或“失”)
得
电子;原子序数为13的元素属于
金属
元素(填“金属”或“非金属”),其氧化物的化学式是
Al2O3
.
(2)从原子结构方面看:①原子序数与元素原子
质子数(核电荷数)
数在数值上相等;②同一周期的元素具有相同的
电子层
数;③我还发现如下规律:
随质子数或原子序数的递增(或从左到右)各原子的(最外层)电子数依次增多;(或同一纵行,原子最外层电子数相同;或同一纵行从上到下电子层数逐渐增加;)
;
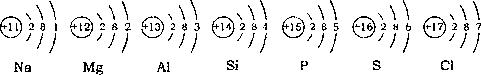
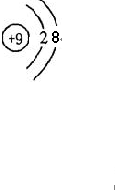
(3)在表中,和Ne原子核外电子排布相同的两种阴离子的离子结构示意图分别是
和
,2种阳离子的离子符号是
Na+
、
Mg2+ (或Al3+)
.





 表示的是
表示的是