
题目列表(包括答案和解析)
碳酸锰
(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业.一种制备MnCO3的生产流程如下图所示.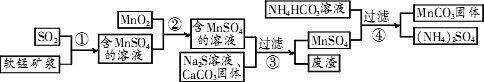
已知生成氢氧化物的
pH和有关硫化物的Ksp如下表: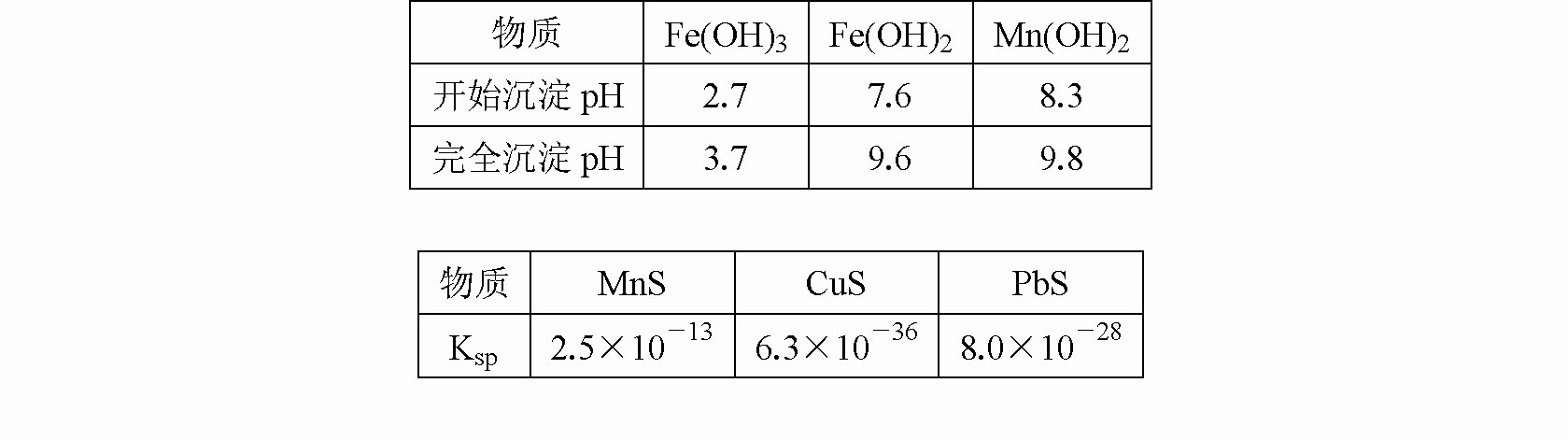
软锰矿主要成分为
MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气.流程①中主要发生的反应有:MnO2+SO2(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH________(填“大”或“小”),该流程可与________(填工业生产名称)联合,生产效益更高.
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为________
________,这样设计的目的和原理是________.
(3)反应②所得的含有MnSO4溶液中,c(Mn2+)=10-6 mol/L,c(Cu2+)=10-10 mol/L,c(Pb2+)=10-10 mol/L,在反应③中加入的Na2S溶液的物质的量浓度的取值范围为________,反应③中碳酸钙的作用是________.
(4)反应④发生的化学反应为:MnSO4+2NH4HCO3![]() MnCO3↓+(NH4)2SO4+CO2↑+H2O.反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是________,溶液的pH不能过低的原因是________.
MnCO3↓+(NH4)2SO4+CO2↑+H2O.反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是________,溶液的pH不能过低的原因是________.
(5)软锰矿中锰的浸出有两种工艺:
工艺
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com