
题目列表(包括答案和解析)
(本题共12分)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
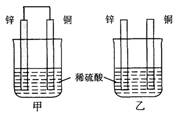
(1)下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的c(H+)均增小
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________。
(5) 甲中锌片上发生的电极反应: _________________________;
(6) 若甲中两电极的总质量为60 g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47 g,则:氢气的体积(标准状况)为________。
(12分
某化学反应2A(g)  B(g)+D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度(mol·L−1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度(mol·L−1)随反应时间(min)的变化情况如下表:

根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20分钟时间内平均速率为 。
(2)在实验2中,A的初始浓度c 2= mol·L−1,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3 υ1(填>、=、<),且c 3= 。
(4)由本次实验,可推测该反应是 反应(选填吸热或放热)。理由是: 。
(5)1~4组实验中,A的平衡转化率最大的是第 组。[来源:Zxxk.Com]
(6)在实验2中,50 min后,若将容器体积增大1倍,则达平衡时B的浓度为 ;该反应的平衡常数K (填“不变”、“增大”或“减小”)。
(12分)(1)“嫦娥一号”登月成功,实现了中国人“奔月”的梦想.“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点是相同质量时,氢气放出的热量多,产物为水无污染。
已知:H2(g)+O2(g)=H2O(l) ΔH=-285.8 kJ/mol ; H2(g)=H2(l) ΔH=-0.92 kJ/mol
O2(g)=O2(l) ΔH=-6.84 kJ/mol ; H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
请写出液氢和液氧生成气态水的热化学方程式:_______________________________.
(2)已知:①NH3(g)+HCl(g)===NH4Cl(s) ΔH=-176 kJ/mol
②NH3(g)+H2O(l)===NH3·H2O(aq) ΔH=-35.1 kJ/mol
③HCl(g)===HCl(aq) ΔH= -72.3 kJ/mol
④NH3·H2O(aq)+HCl(aq)===NH4Cl(aq)+H2O(l) ΔH=-52.3 kJ/mol
则NH4Cl(s)===NH4Cl(aq)的ΔH=______
(3)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
① 理论上稀强酸、稀强碱反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 __
② 假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容
c=4.18 J/(g·℃).为了计算中和热,实验时还需测量的数据有(填序号)__________;
| A.反应前盐酸溶液的温度 | B.反应前盐酸溶液的质量 |
| C.反应前氢氧化钠溶液的温度 | D.反应前氢氧化钠溶液的质量 |
| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(12分)短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示:
| | B | C | D | |
| A | | E | ||
(12分)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。

表1.几种砷酸盐的Ksp 表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=______________mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=______________,若混合溶液
中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是_______________mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式_________________________。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为______________;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为_____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com