
题目列表(包括答案和解析)
(09江苏高考化学)(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)=N2O4(g) 达到平衡。其它条件不变时,下列措施能提高NO2转化率的是 (填字母)。
A.减小NO2的浓度 B.降低温度C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O (l) ,放出19.14kJ
的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O (l)的△H= kJ·mol-1
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g)![]() N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
(4)现用一定量的Cu 与足量的浓HNO3 反应,制得1.00L已达平衡的N2O4和NO2 混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu 多少克?
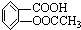 (相对分子质量为180).
(相对分子质量为180).

| 滴定次数 | 0.1mol/L盐酸读数/mL | |
| 滴定前 | 滴定后 | |
| 1 | 0.00 | 17.98 |
| 2 | 1.56 | 16.58 |
| 3 | 0.22 | 15.20 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com