(2013?珠海一模)(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO
4酸性溶液和2mL 0.1mol/L H
2C
2O
4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间.
①需要用
硫酸
硫酸
来酸化KMnO
4溶液,褪色所需时间t
A<
<
t
B(填“>”、“=”或“<”).
②写出该反应的离子方程式
5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O
5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O
.
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作 为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol?L
-1KMnO
4溶液装入
酸式
酸式
(填“酸式”或“碱式”)滴定管,进行滴定操作.
在实验中发现,刚滴下少量KMnO
4溶液时,溶液迅速变成紫红色.将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了.请解释原因:
反应中生成的锰离子具有催化作用,所以随后褪色会加快
反应中生成的锰离子具有催化作用,所以随后褪色会加快
.当
当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化
当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化
,证明达到滴定终点.
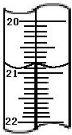
③计算:再重复上述操作2次,记录实验数据如下.
| 序号 |
滴定前读数(mL) |
滴定后读数(mL) |
| 1 |
0.00 |
20.10 |
| 2 |
1.00 |
20.90 |
| 3 |
0.00 |
21.10 |
则消耗KMnO
4溶液的平均体积为
20.00
20.00
mL,已知H
2C
2O
4的相对分子质量为90,则此样品的纯度为
90.00%
90.00%
.
④误差分析:下列操作会导致测定结果偏高的是
ACD
ACD
.
A.未用标准浓度的酸性KMnO
4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO
4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.


 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为:
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为: 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液. (I)下列操作会导致实验结果偏高的是
(I)下列操作会导致实验结果偏高的是