
题目列表(包括答案和解析)
F是有机合成中的重要试剂,工业上可用以下流程合成:
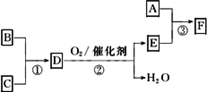
已知A、B、C为单质,D的水溶液呈碱性.A~F常温下均为气体,除A呈黄绿色外,其余均无色,工业上通过电解饱和食盐水得到A.
(1)常温下向D的水溶液中逐滴加人稀盐酸至pH-7,用一个等式表示所得溶液中所有离子浓度之间的关系:________.
(2)取0.3 mol B和0.1 mol C放入容积为1 L的密闭容器中,在一定条件下反应,达到平衡后得到0.12 mol D,此时缩小容器容积为0.5 L,n(D)将________(填“增大”、“减小”或“不变”,下同),反应的平衡常数________.
(3)工业上电解饱和食盐水制取A时,A在________极生成.实验室制取A的化学方程式为:________.
(4)已知反应③中参加反应的A、E物质的量之比为1∶2,则F的化学式为:________.
[s1] F是有机合成中的重要试剂,工业上可用以下流程合成:

已知A、B、C为单质,D的水溶液呈碱性。A~F常温下均为气体,除A呈黄绿色外,其余均无色,工业上通过电解饱和食盐水得到A。
(1)常温下向D的水溶液中逐滴加人稀盐酸至pH一7,用一个等式表示所得溶液中所有离子浓度之间的关系: 。
(2)取0.3 mol B和0.1 mol C放入容积为1 L的密闭容器中,在一定条件下反应,达到平衡后得到0.12 mol D,此时缩小容器容积为0.5 L,![]() (D)将 (填“增大”、“减小”或“不变”,下同),反应的平衡常数 。
(D)将 (填“增大”、“减小”或“不变”,下同),反应的平衡常数 。
(3)工业上电解饱和食盐水制取A时,A在 极生成。实验室制取A的化学方程式为: 。
(4)已知反应③中参加反应的A、E物质的量之比为1:2,则F的化学式为: 。
[s1]17.
[s1] F是有机合成中的重要试剂,工业上可用以下流程合成:

已知A、B、C为单质,D的水溶液呈碱性。A~F常温下均为气体,除A呈黄绿色外,其余均无色,工业上通过电解饱和食盐水得到A。
(1)常温下向D的水溶液中逐滴加人稀盐酸至pH一7,用一个等式表示所得溶液中所有离子浓度之间的关系: 。
(2)取0.3 mol B和0.1 mol C放入容积为1 L的密闭容器中,在一定条件下反应,达到平衡后得到0.12 mol D,此时缩小容器容积为0.5 L, (D)将 (填“增大”、“减小”或“不变”,下同),反应的平衡常数 。
(D)将 (填“增大”、“减小”或“不变”,下同),反应的平衡常数 。
(3)工业上电解饱和食盐水制取A时,A在 极生成。实验室制取A的化学方程式为: 。
(4)已知反应③中参加反应的A、E物质的量之比为1:2,则F的化学式为: 。
[s1]17.


| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红 红 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为 黄绿 黄绿 色 |
继续通入的氯气溶于水使溶液呈黄绿色 继续通入的氯气溶于水使溶液呈黄绿色 |
 ?
?| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红 红 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变为 黄绿 黄绿 色 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com