
题目列表(包括答案和解析)
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
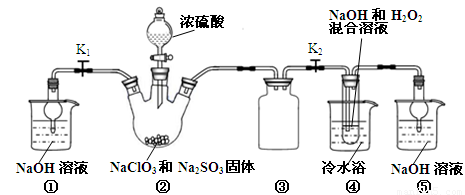
(1)装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 ;装置④中制备NaClO2的化学方程式为 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为 。
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为
。
某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):

(1)D中产生NaHCO3的化学方程式是 。
(2)请结合化学平衡移动原理解释B中溶液的作用 。
(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(称取一定质量的固体,配成1000 mL溶液作为样液,其余固体备用):
① 方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是 。
② 方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是 。
该小组认为不能确定是否存在Na2CO3,你认为该结论是否合理?_____。
③ 方案3:实验小组中甲、乙同学利用NaHCO3的不稳定性进行如下实验:
甲同学:取样液400 mL,用pH计测溶液pH,再水浴加热蒸发至200 mL,接下来的操作是 ,结果表明白色固体中存在NaHCO3。为进一步证明白色固体是否为纯净的NaHCO3 ,结合甲同学实验,还应补充的实验是 。
乙同学:利用仪器测定了固体残留率随温度变化的曲线,如下图所示。

a. 根据A点坐标得到的结论是 。
b. 根据B点坐标,计算残留固体中n(NaHCO3:n(Na2CO3))=
。
通过上述实验,该小组认为,可以向饱和Na2CO3溶液中通入过量CO2制备NaHCO3。
某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):
(1)D中产生NaHCO3的化学方程式是 。
(2)请结合化学平衡移动原理解释B中溶液的作用 。
(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(称取一定质量的固体,配成1000 mL溶液作为样液,其余固体备用):
① 方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是 。
② 方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是 。
该小组认为不能确定是否存在Na2CO3,你认为该结论是否合理?_____。
③ 方案3:实验小组中甲、乙同学利用NaHCO3的不稳定性进行如下实验:
甲同学:取样液400 mL,用pH计测溶液pH,再水浴加热蒸发至200 mL,接下来的操作是 ,结果表明白色固体中存在NaHCO3。为进一步证明白色固体是否为纯净的NaHCO3,结合甲同学实验,还应补充的实验是 。
乙同学:利用仪器测定了固体残留率随温度变化的曲线,如下图所示。
a. 根据A点坐标得到的结论是 。
b. 根据B点坐标,计算残留固体中n(NaHCO3:n(Na2CO3))= 。
通过上述实验,该小组认为,可以向饱和Na2CO3溶液中通入过量CO2制备NaHCO3。
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
(1)装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 ;装置④中制备NaClO2的化学方程式为 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol?L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为 。
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为
。
(10分)化学是一门以实验为基础的自然学科,进化化学实验时要采取正确的实验操作,注意实验安全。
(1)在盛放浓硫酸的试剂瓶的标签上印有如图所示的警示标志,说明浓硫酸是一种 。
(2)下列实验能达到目的的是 。
A.在容量瓶中加一定体积的水,再加入浓盐酸配制准确浓度的稀盐酸
B.用稀硫酸和锌粒反应制氢气时加入少许硫酸铜加快反应速率
C.用玻璃棒搅拌漏斗中的液体以加快过滤的速度
D.加入盐酸以除去硫酸钠中的少量碳酸杂质
E.制取Fe(OH)2时,吸取除去氧气NaOH溶液的胶头滴管的末端插入FeSO4溶液中,再注入NaOH溶液
(3)某化学小组设计如图装置完成一组实验:
A中装硝酸,B中装石灰石,C中装漂白粉溶液,现象是装置II中产生白色沉淀。他得出酸性:HNO3>H2CO3>HClO。由此得出元素非金属:N>C>Cl。你认为他得出的结论是否正确?答: (填“正确”或“不正确”)。理由是 。
(4)有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③某同学设计的下列滴定方式,最合理的是 (夹持部分略去)(填字母序号)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com