
题目列表(包括答案和解析)
KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作如下所示:①称取稍多于所需量的KMnO4固体溶于水中,将溶液加热并保持微沸1 h;②用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;③过滤得到的KMnO4溶液贮存于棕色试剂瓶并放在暗处;④利用氧化还原滴定方法,用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度,KMnO4在滴定中被还原成Mn2+。请回答下列问题:
(1) 准确量取一定体积的KMnO4溶液需要使用的仪器是____________。
(2) 在下列物质中,用于标定KMnO4溶液的基准试剂最好选用________(填序号)。
| A.质量分数为30%的双氧水 | B.FeSO4 | C.摩尔盐 | D.Na2SO3 |
| ||
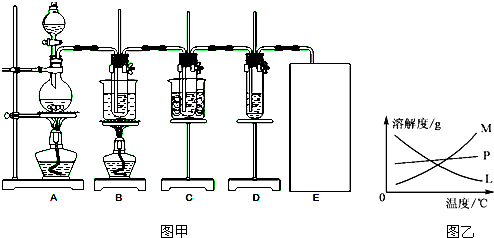
已知Cl2和碱溶液在不同条件下,得到的产物不同。某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。(3Cl2+6KOH KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )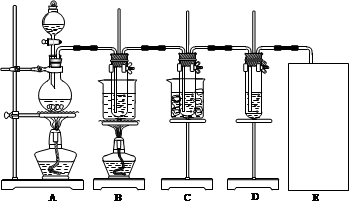
图中:A为氯气发生装置;B的试管里盛有15 mL 30% KOH溶液,并置于水浴中;C的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液。请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过 (填仪器名称)向圆底烧瓶中加入适量的浓盐酸。装置A中反应的离子方程式为 。需要向烧瓶中加碎瓷片吗? (选填:“需要”、“不需要”)。
(2)反应结束后,烧瓶里的溶液 。
A一定显酸性;B可能显酸性,也可能为中性;C只有氧化性;D只有还原性;E既有氧化性又有还原性
(3)反应完毕,B试管中有少量晶体析出,经冷却后,有大量晶体析出。图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体必须用到的玻璃仪器有 。
(4)该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有HCl气体。对此问题可以通过改进实验装置的方法进行避免。方法是 。
(5)实验中可观察到D的试管里溶液的颜色由紫色先变为_________色,最终变为________色。
(6)C装置中反应完毕的现象是______________________________________________。
(7)请在装置图方框中画出缺少的实验装置,并注明试剂。
二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
Ⅰ、(1)合成二甲醚反应一:![]()
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是________.
A、低温高压
B、加催化剂
C、体积不变充入N2
D、增加CO浓度
E、分离出二甲醚
(2)合成二甲醚反应二:2CH3OH(g)![]() CH3OCH3(g)+H2O(g).在不同温度下,分别在1 L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:
CH3OCH3(g)+H2O(g).在不同温度下,分别在1 L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:

该反应是________(填“放热”或“吸热”)反应,原因是________(从平衡常数角度说明).
Ⅱ、二甲醚燃料电池的工作原理如下图一所示.

(1)该电池正极的电极反应式为________.
电池在放电过程中,b对应的电极周凰溶液的pH________.(填“增大”、“减小”或“不变”)
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1 L 0.1 mol/L KCl溶液,写出电解总反应的离子方程式为________.
(3)室温时,按上述(2)电解一段时间后,取25 mL上述电解后溶液,滴加0.2 mol/L醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在________区间(填“AB”、“BC”或“CD”).
②C点溶液中各离子浓度大小关系是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com