
题目列表(包括答案和解析)
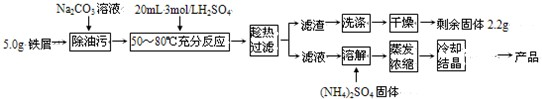 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下:
硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下: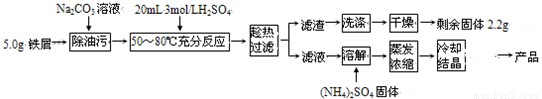
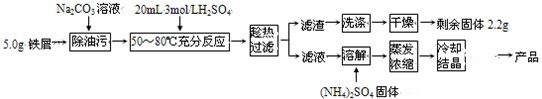 (2009?广州模拟)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下:
(2009?广州模拟)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下: HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2Fe(SO4)2?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2Fe(SO4)2?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com