
题目列表(包括答案和解析)
(8分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。

(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为:H++OH-=H2O | |
(6分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下左图。下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是 。
(2)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2
| | 错误观点 | 离子方程式 |
| ① | 所有的离子方程式均可以表示一类反应 | |
| ② | 所有酸碱中和反应均可表示为:H++OH-=H2O | |
(6分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下左图。下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是 。

(2)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2
|
|
错误观点 |
离子方程式 |
|
① |
所有的离子方程式均可以表示一类反应 |
|
|
② |
所有酸碱中和反应均可表示为:H++OH-=H2O |
|
(11分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。

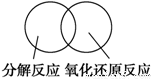
(3)离子方程式是中学生应熟练掌握的化学用语,请写出下列反应的离子方程式:
向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,反应的离子方程式___________________________。在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为_______________________。
(8分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。


(3)离子方程式是中学生应熟练掌握的化学用语,请写出下列反应的离子方程式:
向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,反应的离子方程式_________________________在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为_______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com