化学学习小组为测定某补血剂中硫酸亚铁的含量进行了以下探究:
【查阅资料】本品为糖衣片,除去糖衣后显淡蓝绿色,主要成分硫酸亚铁(FeSO
4?7H
2O).
5Fe
2++MnO
4-+8H
+=5Fe
3++Mn
2++4H
2O
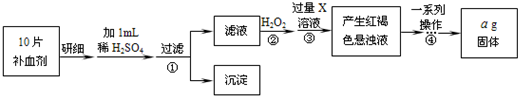
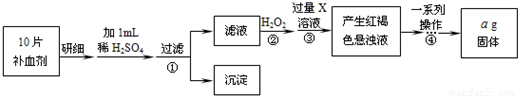
【实验步骤】取本品10片,在适当的条件下配成100mL溶液,分别准确量取20mL溶液,用下列两种方法进行实验:
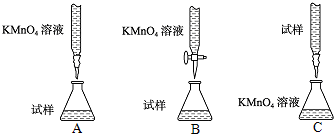
方法一:用一定物质的量浓度的酸性高锰酸钾溶液滴定.
方法二:加过量H
2O
2溶液,然后再加入过量NaOH溶液,得红褐色沉淀,将沉淀过滤并充分加热得红棕色固体,称量该固体的质量.
请回答下列问题:
(1)方法一中,配制一定物质的量浓度的酸性高锰酸钾溶液时,所需要的玻璃仪器除量筒、玻璃棒、胶头滴管、烧杯外还有
容量瓶
容量瓶
.
(2)方法二中,加过量H
2O
2溶液的目的是
使Fe2+完全氧化成Fe3+
使Fe2+完全氧化成Fe3+
.有的同学认为使用新制氯水也能达到此目的,写出反应的离子方程式
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
,和使用新制氯水相比,用H
2O
2溶液的好处是
无污染
无污染
.
(3)在方法一中,若每消耗1mL酸性高锰酸钾溶液相当于0.152g FeSO
4,则该溶液中高锰酸钾的物质的量浓度是
0.2mol?L-1
0.2mol?L-1
.
在方法二中,若称得红棕色固体的质量为a g,则每片补血剂含FeSO
40.95a
0.95a
g.