甲乙两学习小组准备测定某石灰石样品中碳酸钙的质量分数.它们分别采用了不同的测定方法.
甲组同学的方法是:将样品与稀盐酸反应,测定反应后生成CO
2的体积,再根据体积换算为质量,最后根据CO
2的质量求出样品中碳酸钙的质量.下图1为大理石与稀盐酸反应的反应装置,图2用于测量CO
2的体积.
(1)写出图1中仪器的名称:①
长颈漏斗
长颈漏斗
,②
铁架台
铁架台
;
(2)检查图1装置气密性的方法是:
在乳胶管上夹弹簧夹,向长颈漏斗内加水,至形成液封,再加适量水,静置一段时间后,若长颈漏斗液面与试管内液面差保持不变,说明气密性良好(合理均可)
在乳胶管上夹弹簧夹,向长颈漏斗内加水,至形成液封,再加适量水,静置一段时间后,若长颈漏斗液面与试管内液面差保持不变,说明气密性良好(合理均可)
;
(3)图2装置中油层的作用是
防止CO2溶于水
防止CO2溶于水
;
(4)
调节量气管高度,使反应前后两边液面相平
调节量气管高度,使反应前后两边液面相平
(填操作方法)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积.
乙组同学的实验方法是:将采集到的样品用水冲洗后晾干,称取20.00g样品平均分成两份,分别与足量相同质量分数的稀盐酸反应进行下列测定(如图3),经数据处理得到释放出二氧化碳的质量与反应时间的关系图(如图4).
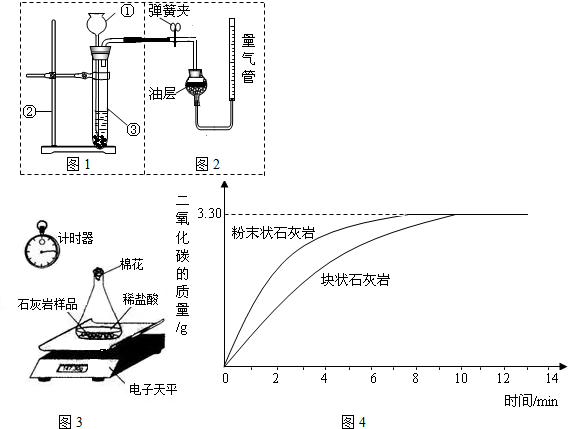
①图3所示实验中数据记录纸上应该连续记录的实验数据是
电子天平示数
电子天平示数
和
计时器示数(答案不分先后顺序)
计时器示数(答案不分先后顺序)
.
②由图4中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,接触面积越
大
大
,其反应速率越
快
快
.
③试求样品中碳酸钙的质量分数(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出).