构建知识网络是学习的一种重要方式.甲同学用“五指法”,归纳出酸溶液的五点化学性质,如图.
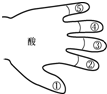
①酸使酸碱指示剂变色.
②酸与活泼金属反应,生成盐和氢气.
③酸与金属氧化物反应,生成盐和水.
④酸与碱发生中和反应,生成盐和水.
⑤酸与某些盐反应,生成新酸和新盐.
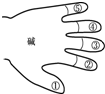
乙同学也用类似的方法,归纳碱溶液的化学性质.请你帮他完成,并写出相应的化学方程式.
①碱溶液使酸碱指示剂变色.
无色酚酞试液遇酸不变色,遇碱溶液变红色.
紫色石蕊试液遇酸变
红
红
色,遇碱溶液变
蓝
蓝
色.
②碱溶液一般不与金属反应.
③碱溶液能与某些非金属氧化物(除CO、NO外)反应,
生成盐和水,如:
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
④碱与酸发生中和反应,生成盐和水,如:
2NaOH+H2SO4=Na2SO4+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
⑤碱溶液与
某些盐反应
某些盐反应
,如:2NaOH+CuSO
4═Cu (OH)
2↓+Na
2SO
4.



