
题目列表(包括答案和解析)
| 阴离子 阳离子 |
OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
| 实验步骤 | 实验现象 | 实验结论 |
| 在少量研碎的水垢中加入适量的蒸馏水充分搅拌,过滤,再滤液中加入 Na2CO3 Na2CO3 溶液 |
有 白色沉淀 白色沉淀 产生 |
水垢中有 氢氧化钙 |

 (2009?泉港区质检)周末,小萌与爸爸经过一鱼塘边,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡.经咨询得知,这种固体俗称“鱼浮灵”,主要成分是过氧化钙(CaO2).
(2009?泉港区质检)周末,小萌与爸爸经过一鱼塘边,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡.经咨询得知,这种固体俗称“鱼浮灵”,主要成分是过氧化钙(CaO2).| 实验步骤 | 可能出现的现象 | 解释与结论 |
| 取反应后试管中的上层清液,加入 碳酸钠 碳酸钠 |
澄清石灰水变浑浊 澄清石灰水变浑浊 |
写出有关反应化学方程式(或解释出现现象的原因): Ca(OH)2+Na2CO3═CaCO3↓+2NaOH Ca(OH)2+Na2CO3═CaCO3↓+2NaOH 则CaO2与H2O反应,所得含钙产物中含有 OH- OH- (填阴离子的符号),即有Ca(OH)2生成. |
 (2012?广陵区二模)珍珠粉由珍珠经加工制成的白色粉末,是重要的药品、化妆品原料.市场上出现的假珍珠粉外观上与真珍珠粉差不多,肉眼无法辨别它们.但假珍珠使用过多会带来健康问题.
(2012?广陵区二模)珍珠粉由珍珠经加工制成的白色粉末,是重要的药品、化妆品原料.市场上出现的假珍珠粉外观上与真珍珠粉差不多,肉眼无法辨别它们.但假珍珠使用过多会带来健康问题.| 操作 | 现象 | 结论与化学反应方程式 |
分别取真假珍珠粉个稍许置于两只试管中,加一定量的稀盐酸后迅速塞紧橡皮塞,将导管的另一端放入石灰水中,观察 |
试管a中均有气泡产生 试管b中实验现象 石灰水变浑浊 石灰水变浑浊 ; |
都含有碳酸盐 a中的化学反应方程式 CaCO3+2HCl═CaCl2+CO2↑+H2O CaCO3+2HCl═CaCl2+CO2↑+H2O ,b中化学反应方程式 Ca(OH)2+CO2═CaCO3↓+H2O Ca(OH)2+CO2═CaCO3↓+H2O ; |
分别取真假珍珠粉稍许置于两只试管c、d中,滴加一定量的浓硝酸,静置后观察 |
C试管内部 有 有 (填“有”、“没有”)少量黄色固体出现;d试管中 没有 没有 (填“有”、“没有”)气泡,无黄色固体出现. |
真珍珠粉中含有少量的蛋白 质 假珍珠粉中不含蛋白质 |
| 样品种类 | 第一次 | 第二次 | 第三次 |
| 假珍珠粉样品(ml) | 110.50 | 110.28 | 110.05 |
| 真珍珠粉样品(ml) | 103.82 | 103.16 | 102.82 |
| ||
| ||
| ||
| ||
| 实验操作步骤 | 实验现象 | 实验结论 |
| ①取样品于试管中,加入适量水,充分振荡后静置并滴加几滴无色酚酞 ②或取样品于试管中,加入适量的稀盐酸 |
①试管中的液体呈红色 ② 没有气泡冒出 没有气泡冒出 |
①样品中含有: 氢氧化钙 氢氧化钙 ②样品中不含有碳酸钙. |
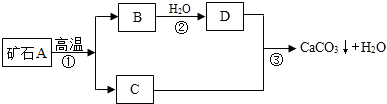
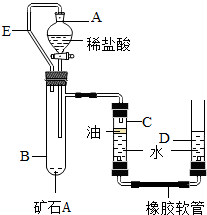 【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.
【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.| 实验次数 项目 |
第一次 | 第二次 | 第三次 |
| 所取矿石A的质量/g | 12 | 12 | 15 |
| 所加稀盐酸的质量/g | 120 | 150 | 100 |
| 剩余物质的质量 | 127.6 | 157.6 | 110.6 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com