
题目列表(包括答案和解析)
 一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质.化学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作:
一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质.化学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作:
 兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:
兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该样品配成溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡. | 有 白色沉淀 白色沉淀 生成. |
说明原固体中一定有 Na2CO3 Na2CO3 . |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. | 溶液变 红 红 色. |
说明原固体中一定有 NaOH NaOH . |
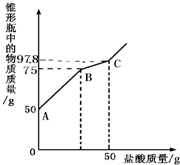 兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:
兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该样品配成溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡. | 有______生成. | 说明原固体中一定有______. |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. | 溶液变______色. | 说明原固体中一定有______. |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com