
题目列表(包括答案和解析)

某中学化学兴趣小组的同学欲通过实验探究,验证精盐中杂质的种类和NaCl的含量。
探究一:这包粗盐中还有什么杂质?
提出问题:粗盐中可能含有较多的CaCl2
请你设计实验验证杂质的成分
| 操作步骤 | 实验现象 | 实验结论 |
探究二:这包粗盐中NaCl的质量分数是多少?
小凡同学按下面的步骤继续进行了实验,请你帮他补充完整。
①称取一定质量的样品(质量为W g)
②将样品加水溶解,制成粗盐溶液
③向粗盐溶液中加入过量的某种试剂,过滤
④沉淀洗涤后小心烘干,得到固体A
⑤向滤液中滴加适量的稀盐酸后,进行某一操作,即可得到纯净的固体B
⑥称量实验中得到的某种固体的质量
(1)在②③⑤的步骤中,都使用到的一种仪器是_________,它在步骤②和⑤中的操作方法相同。但目的不同,其目的分别是_____________,______________________。
(2)步骤⑤进行的“某一操作”是_________________,所需要的主要实验仪器有__________,加入稀盐酸的目的是___________________________。
(3)步骤⑥中,你认为需称量固体A还是固体B的质量____________,你不选择称量另一种固体的理由是:_______________________________。
| 可溶 | MgCl2、CaCl2、Ba(NO3)2、Na2CO3、Na2SO4、Ba(OH)2、BaCl2 |
| 不溶 | CaCO3、Mg(OH)2、BaSO4、BaCO3 |
| 实验步骤一 | 实验涉及的化学反应方程式 | 实验目的 |
| ①将粗盐完全溶于水 | 泥沙等不溶杂质沉淀 | |
| ②加入稍过量的BaCl2溶液 | MgSO4+BaCl2═BaSO4↓+MgCl2 | 除去其中sO42-离子 |
| ③加入稍过量的NaOH溶液 | ______ | 除去其中Mg2+离子 |
| ④加入稍过量的Na2CO3溶液 | CaCl2+Na2CO3═CaCO3↓+2NaCl BaCl2+Na2CO3═BaCO3↓+2NaCl | 除去Ca2+和Ba2+离子 |
| ⑤进行______操作 | 将沉淀物与液体分开 | |
| ⑥滤液中加入适量的盐酸 | Na2CO3+2HCl═2NaCl+CO2+H2O NaOH+HCl═NaCl+H2O | 除去过量的CO32-和OH-离子 |
| ⑦将滤液蒸发、结晶、烘干 | 得到精盐(NaCl) |
我市正在积极打造“海盐文化之都”。食盐是生活必需品,也是重要的化工原料。
(1)某学习小组进行粗盐提纯实验,主要经过以下操作步骤:称量→溶解→_____→蒸发→再次称量→计算产率。在蒸发操作中使用到玻璃棒,作用是_________。
实验结束后,该小组发现所得食盐产率明显低于其他小组,其原因可能是_____。
A.粗盐未充分溶解就过滤
B.倾倒时,有部分氯化钠溶液溅出
C.蒸发后,所得的精盐较潮湿
(2)电解饱和食盐水可以得到多种化工产品,主要过程如下: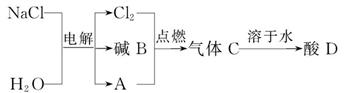
①气体A是密度最小的气体,该气体的名称为________,写出一个由酸D转化为气体A的化学方程式_____________________________________________,
该反应是___________(填“放热”或“吸热”)反应。
②电解后生成的碱B的化学式为_______,你猜想的依据是_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com