
题目列表(包括答案和解析)
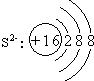
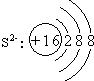


| ||
| ||
原子序数依次增大的A、B、C、D都是元素周期表中前20号元素,B、C、D同周期,A、D同主族,且A的原子结构中最外层电子数是电子层数的3倍。D的最高价氧化物对应的水化物为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:
(1)D的离子结构示意图是 ,A和B形成的化合物中含有非极性共价键的是 ,该物质的电子式是 。
(2)加热时,D单质能跟B的最高价氧化物对应水化物的浓溶液发生氧化还原反应,生成两种盐,该氧化还原反应的离子方程式为 。
(3)写出C的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物反应的离子方程式 。
(8分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
| 化合物 | 甲 | 乙 | 丙 |
| 原子个数比 | B∶A=1∶3 | C∶A=1∶2 | D∶A=1∶2 |
原子序数依次增大的A、B、C、D、E、F六种短周期元素①原子半径由大到小顺序是D>E>F>B>C>A②E是同周期中离子半径最小的元素,F是同周期中原子半径最小的元素③B的最高价氧化物的水化物和氢化物反应生成盐④C和D可以形成1:1和1:2的两种常见化合物。
回答:
①C和D生成1:1的化合物的电子式: 。
②用电子式表示A和B形成的化合物的形成过程
③E的电高价氧化物水化物和B的最高价氧化物的水化物反应的离子方程式
④F的单质和强碱反应的离子方程式为
⑤A、C、D、E、F的简单离子的半径由大到小的顺序是(用元素的离子符号表示)
⑥用离子方程式说明B与A形成的氢化物结合H+能力强于C与A形成的氢化物:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com