
题目列表(包括答案和解析)
| ||
纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域.工业上以食盐、氨气
(主要由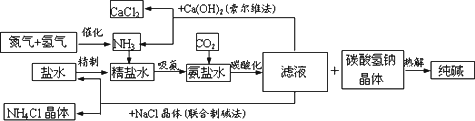
根据以上信息回答下列问题.
(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的
Ca2+、Mg2+等沉淀,可以向其中加入过量纯碱.此时将混合液中不溶物除去的方法是________;溶液中多余的纯碱可以加________试剂来除去.(2)上述工艺流程中,加压条件下通入二氧化碳进行碳酸化时没有析出碳酸钠晶体,其原因是
________.(3)在氨碱工业的历史上,如何处理流程中剩余的滤液,出现了两种工艺:一是“索尔维法”,即在滤液中加入石灰水;二是我国化学家侯德榜发明的“联合制碱法”,即在滤液中加入适量氯化钠晶体.
①“索尔维法”中,滤液加石灰水前先要加热,原因是
________________.②“联合制碱法”中,可以循环利用的物质是
________(用化学式表示).(4)若采用上述流程生产
106吨纯碱,则理论上通入的二氧化碳的体积(标准状况下)不得少于________L(不考虑二氧化碳的回收利用).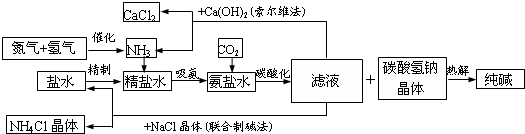
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com