
题目列表(包括答案和解析)
向滴有石蕊试液的稀盐酸中,慢慢滴入过量氢氧化钠溶液,石蕊颜色变化的过程是( )
A、红→蓝→紫 B、紫→蓝→红 C、蓝→紫→红 D、红→紫→蓝
 某化学兴趣小组对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究.
某化学兴趣小组对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究.| 实验步骤 | 实验现象 | 结论 |
| 取2mL NaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入锌粒 | 若 锌粒表面产生气泡 锌粒表面产生气泡 |
盐酸过量 |
| 若没有明显现象 | NaOH溶液与稀盐酸恰好完全反应 |
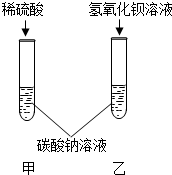 甲乙两同学为了验证碳酸钠的化学性质,做了如图所示的实验.乙同学的实验中发生反应的化学方程式为
甲乙两同学为了验证碳酸钠的化学性质,做了如图所示的实验.乙同学的实验中发生反应的化学方程式为| 实验方案 | 现象 | 结论 | |
| 甲同学 | 向试管中滴加石蕊溶液 | 溶液变红 溶液变红 |
猜想①正确 |
| 乙同学 | 向试管中滴加稀盐酸 | 无明显现象 | 猜想①正确 |
 (2009?邵阳)2009年邵阳市九年级化学实验操作技能考试中,小聪同学抽到的试题是“探究酸和碱之间的中和反应“.他向盛有氢氧化钠溶液的烧杯中缓慢滴加稀盐酸,一会儿后,想起忘记加指示剂了,便补加几滴无色酚酞溶液,搅拌,观察到溶液不变色,于是他得出“酸碱恰好完全中和”的结论.
(2009?邵阳)2009年邵阳市九年级化学实验操作技能考试中,小聪同学抽到的试题是“探究酸和碱之间的中和反应“.他向盛有氢氧化钠溶液的烧杯中缓慢滴加稀盐酸,一会儿后,想起忘记加指示剂了,便补加几滴无色酚酞溶液,搅拌,观察到溶液不变色,于是他得出“酸碱恰好完全中和”的结论.| 实验步骤 | 实验现象 | 实验结论 |
取少量溶液于试管中,滴入几滴 紫色石蕊溶液 取少量溶液于试管中,滴入几滴 紫色石蕊溶液 |
溶液变红色 溶液变红色 |
稀盐酸过量 稀盐酸过量 |
溶液仍为紫色 (或不变色) 溶液仍为紫色 (或不变色) |
恰好完全中和 恰好完全中和 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com