(2012?扬中市模拟)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH
3、CO
2等为原料先制得NaHCO
3,进而生产出纯碱.有关反应的化学方程式为:
NH
3+CO
2+H
2O═NH
4HCO
3;
NH
4HCO
3+NaCl═NaHCO
3↓+NH
4Cl;
2NaHCO
3Na
2CO
3+CO
2↑+H
2O
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
c
c
(填字母标号).
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解 c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
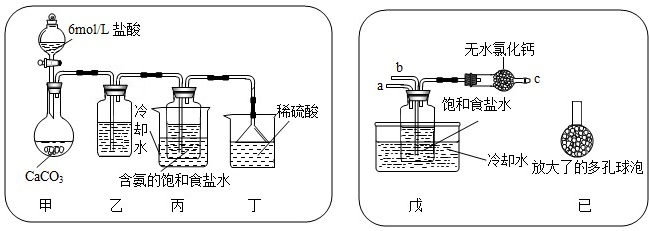
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 饱和的碳酸氢钠溶液,作用是
吸收甲装置可能挥发出的氯化氢气体
吸收甲装置可能挥发出的氯化氢气体
;
(Ⅱ)丁装置中稀硫酸的作用是
吸收末反应的NH3
吸收末反应的NH3
;
(Ⅲ)实验结束后,分离出NaHCO
3晶体的操作是
过滤
过滤
(填分离操作的名称).
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从
a
a
管通入
氨气
氨气
气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
增大气体与溶液接触面积,提高CO2吸收率
增大气体与溶液接触面积,提高CO2吸收率
;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:
用碳酸氢铵与适量饱和食盐水反应.(或往烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等.其他合理方法均可)
用碳酸氢铵与适量饱和食盐水反应.(或往烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等.其他合理方法均可)
.
(4)“纯碱中常常会混有少量氯化钠.”某研究性学习小组以一包纯碱(只考虑含氯化钠)为研究对象,探究纯碱样品中碳酸钠的含量.
【实验设计】
甲方案
Ⅰ.设计思路:根据样品与氯化钙溶液反应生成沉淀碳酸钙的质量,求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
Ⅱ.操作步骤:称取13.25g纯碱样品,加入过量的氯化钙溶液,充分搅拌.过滤、洗涤、干燥,得到的白色沉淀10.00g.
Ⅲ.数据处理:请根据上述实验数据,计算该样品中碳酸钠的质量分数.
计算过程:
解:设纯碱样品中含Na
2CO
3的质量为x
Na
2CO
3+CaCl
2═CaCO
3↓+2NaCl
106 100
x 10.00g
=x=10.6g
纯碱样品中Na
2CO
3的质量分数为
×100%=80%
解:设纯碱样品中含Na
2CO
3的质量为x
Na
2CO
3+CaCl
2═CaCO
3↓+2NaCl
106 100
x 10.00g
=x=10.6g
纯碱样品中Na
2CO
3的质量分数为
×100%=80%
乙方案
I.设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
II.实验结论:
(1)当a、b的质量关系满足
(填写含a、b字母的表达式,下同)时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100%.
(2)当a、b的质量关系满足
时,纯碱样品室有碳酸钠和少量氯化钠组成的混合物,样品中碳酸钠的质量分数是
.
【实验评价】
误差分析:
(一)甲方案中,白色沉淀的质量在过滤、干燥等操作过程中会有所损耗,造成计算结果与实际值相比偏小.如果将氯化钙溶液换成氯化钡溶液,则可以使误差减小,理由是
BaCl2比CaCl2的相对分子质量大,产生的沉淀质量大,称量误差小
BaCl2比CaCl2的相对分子质量大,产生的沉淀质量大,称量误差小
.
(二)乙方案中,有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比
偏小
偏小
(填“偏大”、“偏小”、或“不变”).