
题目列表(包括答案和解析)
酸、碱、盐是初中化学学习的重要内容,同学们在实验室对酸、碱、盐的性质进行探究。
(1)酸和碱的组成中都含有氢元素,右图是氢在元素周期表中的一些信息,下列说法中错误的是___________。
A.氢元素属于非金属元素 B.氢原子核内质子数为1
C.氢原子的质量为1.008 D.氢原子的结构示意图为![]()
(2)盐酸和硫酸具有很多相似的化学性质,这是因为其溶液中都含有________(填符号)。
(3)小华同学打开盛放浓硫酸和浓盐酸的试剂瓶盖后![]() ,立即就能把它们区分开来,这是为什么?
,立即就能把它们区分开来,这是为什么?
(4)在进行酸碱中和反应的实验时,小明同学向烧杯中的氢氧化钠溶液滴加稀硫酸,一会儿发现由于忘记了滴加酚酞指示剂,因而无法确定稀硫酸与氢氧化钠是否恰好完全反应。
①同学们对溶质的成分提出了自己的看法:
小贝同学说:溶质除了硫酸钠还有氢氧化钠;小华同学说:溶质除了硫酸钠还有稀硫酸;小明同学说:溶质________ __
___________________。
②为了证明大家的猜想,老师取出少量反应后的溶液于一支试管中,并向试管中滴![]() 加几滴酚酞溶液,振荡,观察到
加几滴酚酞溶液,振荡,观察到![]() 溶液无明显变化。 则这三位同学的猜想中不正确的是 。
溶液无明显变化。 则这三位同学的猜想中不正确的是 。
(5)小钢同学要配制70g溶质质量分数为5.4%的氯化铜溶液,经计算,他需要称量氯化铜的质量为__________g。
氯化铜溶液是蓝色的溶液,氯化铜溶液中主要含有Cu2+、Clˉ和水分子。某探究小组为探究氯化铜溶液中的哪种微粒能使氯化铜溶液显蓝色,设计了如下实验方案,得出了初步结论。请填写下表中的实验结论:
| 实 验 操 作 | 实验现象 | 实 验 结 论 |
| 取少量氯化钠固体,放入 试管中,加水,振荡 | 固体溶解, 溶液呈无色 |
 (6)取50g溶质质量分数为5.4%的氯化铜溶液于烧杯中,向烧杯中加入50g氢氧化钠溶液,二者正好完全反应,求反应后生成沉淀的质量。
(6)取50g溶质质量分数为5.4%的氯化铜溶液于烧杯中,向烧杯中加入50g氢氧化钠溶液,二者正好完全反应,求反应后生成沉淀的质量。

酸、碱、盐是初中化学学习的重要内容,同学们在实验室对酸、碱、盐的性质进行探究。
(1)酸和碱的组成中都含有氢元素,右图是氢在元素周期表中的一些信息,下列说法中错误的是___________。
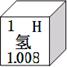
A.氢元素属于非金属元素 B.氢原子核内质子数为1
C.氢原子的质量为1.008
D.氢原子的结构示意图为
(2)盐酸和硫酸具有很多相似的化学性质,这是因为其溶液中都含有________(填符号)。
(3)小华同学打开盛放浓硫酸和浓盐酸的试剂瓶盖后,立即就能把它们区分开来,这是为什么?
(4)在进行酸碱中和反应的实验时,小明同学向烧杯中的氢氧化钠溶液滴加稀硫酸,一会儿发现由于忘记了滴加酚酞指示剂,因而无法确定稀硫酸与氢氧化钠是否恰好完全反应。

①同学们对溶质的成分提出了自己的看法:
小贝同学说:溶质除了硫酸钠还有氢氧化钠;小华同学说:溶质除了硫酸钠还有稀硫酸;小明同学说:溶质________ _____________________。
②为了证明大家的猜想,老师取出少量反应后的溶液于一支试管中,并向试管中滴加几滴酚酞溶液,振荡,观察到溶液无明显变化。 则这三位同学的猜想中不正确的是 。
(5)小钢同学要配制70g溶质质量分数为5.4%的氯化铜溶液,经计算,他需要称量氯化铜的质量为__________g。
氯化铜溶液是蓝色的溶液,氯化铜溶液中主要含有Cu2+、Clˉ和水分子。某探究小组为探究氯化铜溶液中的哪种微粒能使氯化铜溶液显蓝色,设计了如下实验方案,得出了初步结论。请填写下表中的实验结论:
|
实 验 操 作 |
实验现象 |
实 验 结 论 |
|
取少量氯化钠固体,放入 试管中,加水,振荡 |
固体溶解, 溶液呈无色 |
|
(6)取50g溶质质量分数为5.4%的氯化铜溶液于烧杯中,向烧杯中加入50g氢氧化钠溶液,二者正好完全反应,求反应后生成沉淀的质量。


| | 实验方案 | 实验现象 | 实验结论 |
| 方 案 一 | 将Fe丝浸入CuSO4溶液中 | Fe丝表面有红色物质析出 | 金属活动性:Fe_ _Cu(填“>”或“<”)该反应的反应类型属于 ____________反应。 |
| 方 案 二 | 将Mg和Cu分别在空气中灼烧 | 发现镁能剧烈燃烧,而另一种不能 | 金属活动性:Mg_ _Cu(填“>”或“<”) |
| 方 案 三 | 分别将Mg和Fe放入_________中,观察现象 | 观察到_ (填元素符号)产生气泡的速度较慢 | 金属活动性顺序:Mg>Fe |
探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力。
【提出问题】催化剂能加快反应速率,但自身质量和化学性质不变。
【查阅资料】①已知KClO3分解产生氧气和KCl; ②KClO3和KCl都能溶于水,MnO2难溶于水;③MnO2与浓盐酸在加热时能产生黄绿色的Cl2.
【设计实验】
实验一、取两份质量相等(约5克)的KClO3分别放入两只大试管(分别标记A和B)中,往B试管中加入质量为1.0克MnO2的,然后按图所示组装好仪器,加热。结果发现加了MnO2的装置收集满一集气瓶的气体所用的时间要少。

实验二、待装置完全冷却之后,将B管中物质置于烧杯中加水溶解、过滤;再将滤出物干燥、称量得质量约为1.0克。
实验三 、取少量滤出物与浓盐酸置于反应装置中(放在通风橱中),加热;有黄绿色气体产生。根据以上实验回答下列问题:
(1)实验一说明加了MnO2之后,KClO3分解的速率更快,写出这一反应的化学方程式:
;如何验证集气瓶中的气体为氧气 。
(2)通过上述三个实验能说明 。
(3)某同学用KClO3和KMnO4的混合物加热,发现产生氧气的速度也很快,该同学就断定KMnO4在KClO3分解反应中也能起催化作用,你认为这同学的判断对吗? ;为什么? 。
27.(每空1分,7分) 某化学兴趣小组的同学为了探究Mg、Cu、Fe的金属活动性顺序开展了一下以下探究活动。
(1)进行试验,获得结论。完成如下实验报告,并回答有关问题。
|
|
实验方案 |
实验现象 |
实验结论 |
|
方 案 一 |
将Fe丝浸入CuSO4溶液中 |
Fe丝表面有红色物质析出 |
金属活动性:Fe_ _Cu(填“>”或“<”)该反应的反应类型属于 ____________反应。 |
|
方 案 二 |
将Mg和Cu分别在空气中灼烧 |
发现镁能剧烈燃烧,而另一种不能 |
金属活动性:Mg_ _Cu(填“>”或“<”) |
|
方 案 三 |
分别将Mg和Fe放入_________中,观察现象 |
观察到_ (填元素符号)产生气泡的速度较慢 |
金属活动性顺序:Mg>Fe |
 (2)反思与交流。经过讨论,该小组同学一致认为:比较金属与酸反应产生氢气的快慢,有两种测定方法:
(2)反思与交流。经过讨论,该小组同学一致认为:比较金属与酸反应产生氢气的快慢,有两种测定方法:
方法1是在相同时间内测量氢气体积的大小。若用右图所示装置测量,则接口c应与______(填“a”或“b”)相连。
方法2是测定产生相同体积氢气时_____________________。
探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力。
【提出问题】催化剂能加快反应速率,但自身质量和化学性质不变。
【查阅资料】①已知KClO3分解产生氧气和KCl;②KClO3和KCl都能溶于水,MnO2难溶于水;③MnO2与浓盐酸在加热时能产生黄绿色的Cl2.
【设计实验】
实验一、取两份质量相等(约5克)的KClO3分别放入两只大试管(分别标记A和B)中,往B试管中加入质量为1.0克MnO2的,然后按图所示组装好仪器,加热。结果发现加了MnO2的装置收集满一集气瓶的气体所用的时间要少。

实验二、待装置完全冷却之后,将B管中物质置于烧杯中加水溶解、过滤;再将滤出物干燥、称量得质量约为1.0克。
实验三 、取少量滤出物与浓盐酸置于反应装置中(放在通风橱中),加热;有黄绿色气体产生。根据以上实验回答下列问题:
(1)实验一说明加了MnO2之后,KClO3分解的速率更快,写出这一反应的化学方程式:
;如何验证集气瓶中的气体为氧气 。
(2)通过上述三个实验能说明 。
(3)某同学用KClO3和KMnO4的混合物加热,发现产生氧气的速度也很快,该同学就断定KMnO4在KClO3分解反应中也能起催化作用,你认为这同学的判断对吗? ;为什么? 。
27.(每空1分,7分) 某化学兴趣小组的同学为了探究Mg、Cu、Fe的金属活动性顺序开展了一下以下探究活动。
(1)进行试验,获得结论。完成如下实验报告,并回答有关问题。
|
| 实验方案 | 实验现象 | 实验结论 |
| 方 案 一 | 将Fe丝浸入CuSO4溶液中 | Fe丝表面有红色物质析出 | 金属活动性:Fe_ _Cu(填“>”或“<”)该反应的反应类型属于 ____________反应。 |
| 方 案 二 | 将Mg和Cu分别在空气中灼烧 | 发现镁能剧烈燃烧,而另一种不能 | 金属活动性:Mg_ _Cu(填“>”或“<”) |
| 方 案 三 | 分别将Mg和Fe放入_________中,观察现象 | 观察到_ (填元素符号)产生气泡的速度较慢 | 金属活动性顺序:Mg>Fe |
 (2)反思与交流。经过讨论,该小组同学一致认为:比较金属与酸反应产生氢气的快慢,有两种测定方法:
(2)反思与交流。经过讨论,该小组同学一致认为:比较金属与酸反应产生氢气的快慢,有两种测定方法:
方法1是在相同时间内测量氢气体积的大小。若用右图所示装置测量,则接口c应与______(填“a”或“b”)相连。
方法2是测定产生相同体积氢气时_____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com