我国化工专家侯德榜曾为世界制碱工业作出了突出贡献.“侯氏制碱法”是以食盐、氨气、二氧化碳等为原料先制得N.HCq,进而生产出纯碱.其生产过程用化学方程式可简要表示为:
①NH
3+H
2O+CO
2=NH
4HCO
3;②NH
4HCO
3+NaCl=NaHCO
3↓+NH
4Cl;③2NaHCO
3Na
2CO
3+H
2O+CO
2↑.
(1)“侯氏制碱法”生产过程中涉及到的基本反应类型是
.
A.置换反应;B.化合反应;C.分解反应;D.复分解反应
(2)第②步中加入的是磨细的食盐粉,食盐磨细的目的是
.
若第②步中得到的NaHCO
3中含有少量的NH
4HCO
3,但不会影响产品Na
2CO
3的纯度,原因是
.
(3)若纯碱中含有NaHCO
3杂质,为测定试样中纯碱的质量分数,用右图中的装置进行实验.主要实验步骤如下:
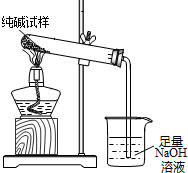
用天平准确称量出干燥试管的质量为20.2克,然后称取4.0克已研碎的纯碱样品并放入干燥的试管中.用酒精灯加热,待充分反应并冷却后,在天平上称出试管和碳酸钠的质量23.5克.
①停止加热前,要进行的操作是
.
②该试样中纯碱的质量分数为
.


 Na2CO3+H2O+CO2↑.
Na2CO3+H2O+CO2↑.
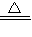 Na2CO3+H2O+CO2↑.
Na2CO3+H2O+CO2↑.