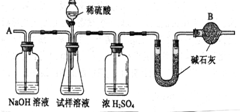
工业纯碱中常含有微量的NaCl杂质,为测定其质量是否达到合格产品的要求,化学探究小组的同学配合国家“质量万里行”设计了如下实验方案.图中所使用的仪器和药品已由下面的装置图中给出.
主要实验步骤如下:
①检查装置的气密性
②称取a g(准确到0.1g,下同)试样放入锥形瓶中,加适量蒸馏水溶解
③称量盛有碱石灰的U型管的质量为b g
④从分解漏斗滴加一定量的硫酸溶液,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量为c g
⑦重复步骤⑤⑥的操作,至称量所得的质量基本不变为d g
试回答下列问题:
(1)步骤②和③两次称取(量)的操作上显著的不同之处是
添加砝码的方式不同,②中称取先定砝码(游码)的质量(ag),③中称量,砝码(游码)试加时先大后小
添加砝码的方式不同,②中称取先定砝码(游码)的质量(ag),③中称量,砝码(游码)试加时先大后小
.
(2)实验中使用NaOH溶液和碱石灰的一个共同的作用是
吸收CO2
吸收CO2
.
(3)如果将实验中的硫酸溶液换成相同浓度的盐酸,测定的结果将
偏高
偏高
(填写“偏高”、“偏低”或“不变”).其原因是
盐酸易挥发,浓H2SO4不能除不HCl,被U形管中碱石灰吸收
盐酸易挥发,浓H2SO4不能除不HCl,被U形管中碱石灰吸收
.
(4)步骤⑤(⑦)操作时要求“缓缓鼓入”的目的是
鼓入空气太快会导致U形管内碱石灰吸收CO2不完全
鼓入空气太快会导致U形管内碱石灰吸收CO2不完全
.
(5)利用上述实验中获得的数据,该工业纯碱的纯度为
(需有过程)
(6)完成本实验的方案不止一种,沉淀法便是其中的一种.化学探究小组的同学经讨论后认为若以该法实验,可供选择的试剂可能有:
A.Ba(NO
3)
2(BaCl
2)溶液 B.Ca(NO
3)
2(CaCl
2)溶液 C.AgNO
3、稀HNO
3溶液
你认为可行的有
A、B、C
A、B、C
(填序号)

 工业纯碱中常含有微量的NaCl杂质,为测定其质量是否达到合格产品的要求,化学探究小组的同学配合国家“质量万里行”设计了如下实验方案.图中所使用的仪器和药品已由下面的装置图中给出.
工业纯碱中常含有微量的NaCl杂质,为测定其质量是否达到合格产品的要求,化学探究小组的同学配合国家“质量万里行”设计了如下实验方案.图中所使用的仪器和药品已由下面的装置图中给出.