
题目列表(包括答案和解析)
| 同学 | 步骤 | 实 验 操 作 | 实验现象 | 实验结论 |
| 甲 | I | 取少量溶液,滴入酚酞试液 | 溶液变成红色 | 有NaOH |
| Ⅱ | 取少量原溶液,滴入饱和石灰水 | 产生白色沉淀 | 有Na2CO3 | |
| 乙 | I | 取少量溶液,滴入适量氯化钙溶液 | 产生白色沉淀 | 有Na2CO3 |
| Ⅱ | 对 I进行过滤,向滤液滴入酚酞试液 | 滤液变成红色 | 有NaOH |
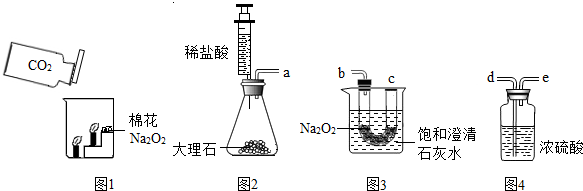
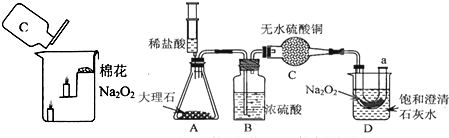
学习完氢氧化钠后,我们对碱的知识有了一些了解。请回答下列问题:
(1)如将石蕊试液滴入NaOH溶液中,石蕊试液会由紫色变成 色。
(2)我们知道固体NaOH必须密封保存,该固体暴露在空气中容易吸收水分而发生_____
此外NaOH还会变质。请用化学反应方程式表示其变质的原因_____。
(3)酸与碱作用生成盐和水的反应,化学上叫做_____反应。
(4)氢氧化钠溶液能够与盐溶液发生反应,你选择合适物质_____。(填序号)
A.Na2CO3溶液 B.FeCl3溶液 C.BaCl2溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com