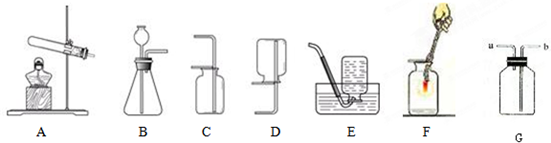
实验室提供以下常用仪器,供完成下列气体制取实验时选用(不可重复选用)

(1)实验室采用加热高锰酸钾固体制取O
2时,其发生装置必需选用上述仪器中的(填写序号,下同)
①③④
①③④
,还缺少的仪器是
带导管的橡皮塞
带导管的橡皮塞
.
(2)过氧化氢(H
2O
2)俗称双氧水,常温下是一种无色液体,它在土豆块的催化作用下能迅速分解,放出氧气.有关的文字表达式为
采用该反应原理制取O
2,并且在实验过程中可以随时添加双氧水,上述仪器中必需使用的有
⑥
⑥
.
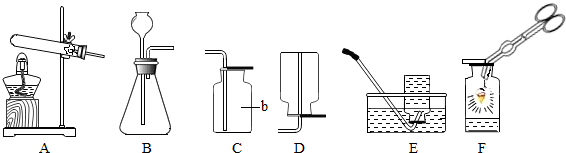
(3)若直接使用如图所示装置收集O
2,O
2由
b
b
口进入;若将装置中充满水,O
2由
a
a
口进入.
(4)某研究性学习小组选择“H
2O
2生成(O
2)的快慢与什么因素有关“的课题进行探究,以下是他们探究的主要过程:
查阅资料H
2O
2在常温下会分解成H
2O和O
2,在催化剂的作用下,分解速率增大.
假设1.H
2O
2生成O
2的快慢与催化剂种类有关
假设2.H
2O
2生成O
2的快慢与催化剂用量有关
| 实验编号 |
反应物 |
催化剂 |
时间 |
| 1 |
6%H202 |
1g红砖粉 |
152s |
| 2 |
6%H202 |
1gMnO2 |
35s |
实验方案1常温下,在两瓶相同体积相同浓度的H
2O
2溶液中分别加入相同质量的MnO
2和红砖粉,测量各生成一瓶湘同体积)O
2所需要的时间.
结论1该探究过程得出的结论是
二氧化锰催化效果比红砖粉好
二氧化锰催化效果比红砖粉好
.
实验方案2常温下,每次均用30mL10%的H
2O
2溶液,使用不同量的二氧化锰粉末作催化剂,测定每次收集到500mL氧气时所用的时间,结果如下(其他实验条件均相同):
| 实验次序 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| 二氧化锰粉末用量/g |
0.1 |
0.2 |
0.3 |
0.4 |
0.5 |
0.6 |
0.7 |
0.8 |
0.9 |
1.0 |
| 所用时间/s |
17 |
8 |
7 |
5 |
4 |
3 |
2 |
2 |
2 |
2 |
结论2该探究过程得出的结论是
在一定范围内,生成氧气快慢与催化剂用量有关
在一定范围内,生成氧气快慢与催化剂用量有关
.