
题目列表(包括答案和解析)
某物质可以用来作CO2气体的干燥剂,则该物质( )
A.能与CO2反应 B.是浓硫酸
C.能与水反应 D.能吸收空气中的水份,不与CO2反应
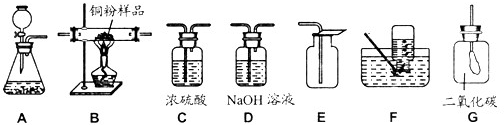
实验室有下列几种装置:
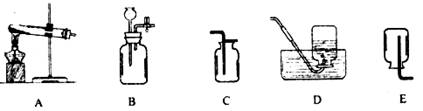
(1)实验室制取CO2气体,选用的发生装置为 ,收集装置为 ,用双氧水制O2的文字表达式为 。
(2)实验室如果用高锰酸钾来制O2,所用的发生装置为 。待反应完全后,欲从反应后的物质中提取干燥、纯净的MnO2(含K元素的物质均溶于水)其操作的步骤为 → → → 。
(3)某化学兴趣小组的同学为检验Al2O3能否催化双氧水进行了如下探究过程。
①问题:Al2O3能否作为双氧水分解的消化剂呢?
②猜想:Al2O3能作为双氧水分解的催化剂。
③实验验证:
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 |
| 木条不复燃 | 常温下双氧水不分解 |
| 实验二 | 在装有双氧水的试管中加入少量,Al2O3然后将带火星的木条伸入试管中。 | 木条复燃 |
④结论:Al2O3能加快双氧水的分解速率,故Al2O3可作为双氧水分解的催化剂。
⑤讨论与反思:经过讨论,有的同学认为只有上述两个证据:不能证明Al2O3能作为双氧水分解的催化剂,还要补充一个探究实验:
实验三:
实验目的:探究
实验步骤:A B完成实验二,
C 待反应结束后,将从实验二的物质提取Al2O3,称量;
D 对比反应前的Al2O3质量。
讨论:如果Al2O3在反应前后质量不变,则说明Al2O3可以作为双氧水分解的催化剂。
⑥但小华认为,要证明猜想,上述三个实验还不够,还需再增加一个探究实验。
探究
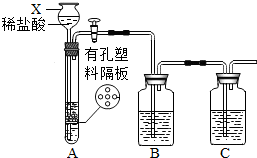 某研究性学习小组设计并进行了如下实验.
某研究性学习小组设计并进行了如下实验.
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com