
题目列表(包括答案和解析)
氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂.
[资料在线]
Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体.
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气.
Ⅲ.用氢气与金属钙加热的方法可制得氢化钙.
Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝.
[探究一:定性分析]
(1)对于“金属钙与水反应生成的气体”有如下猜想:甲.氧气,乙.氢气
你支持________(填“甲”、“乙”)观点,理由是________.
(2)CaH2中氢元素的化合价是________,写出CaH2与水反应的化学方程式________;
(3)登山运动员常携带氢化钙作为能源提供剂,与携带氢气相比,其优点是________;
(4)用氢气与金属钙加热可得到氢化钙,以下是反应装置图.
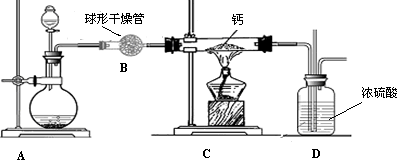
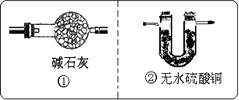
装置A中装有锌粒和稀硫酸,请写出其反应的化学方程式________,装置B中装有无水氯化钙,其作用是________,若要证明进入C装置中的氢气已经干燥,在B、C之间应连接下图中的哪个装置:________(填①或②),现象是________.
(5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验确有CaH2生成.你认为是否正确________(填“是”或“否”);原因是________.
[探究二:产物定量测定]
测定原理:根据金属钙、氢化钙都能与水反应生成气体的原理,采用测定气体的体积的方法.
(1)取氢化钙样品与水反应,利用下图装置测定生成的气体体积时,在________即进行收集(填字母).

A.气泡连续均匀时
B.刚开始有气泡时
(2)利用该装置,测得的气体体积总是会偏小,同学讨论后采用下图装置测定气体体积.该装置的优点是________,如何实现A中的水与B中样品接触而发生反应________.
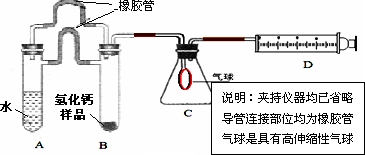
(3)称取46 mg所制得的氢化钙样品,注射器D开始时活塞停留在10 mL刻度处,反应结束后充分冷却,活塞最终停留57.04 mL刻度处.试通过计算求出样品中氢化钙的纯度(即氢化钙在样品中的质量分数)是________.(设该条件下每11.2 mL氢气的质量为1 mg)
[反思提高]
(1)上述实验在学校的实验室内,通过托盘天平等称量工具________(填“能”、“不能”)完成.
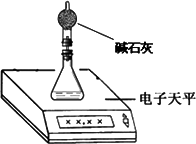
(2)测量小组利用电子天平,采用如下图所示方法以反应前后失去的质量来求算纯度,结果纯度的测定值偏________.
| ||
| ||

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com