
题目列表(包括答案和解析)
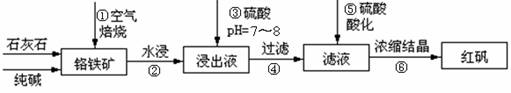
工业上生产红矾(重铬酸钠Na2Cr2O7)的原料为铬铁矿(可视为FeO·Cr2O3、还含有Al2O3、SiO2).某研究性学习小组模拟工业生产红矾的原理制备红矾,并以红矾为原料制备少量的重铬酸钾(K2Cr2O7).实验流程为:

已知焙烧时Al2O3、SiO2发生反应:
SiO2+CaCO3![]() CaSiO3+CO2↑ Al2O3+Na2CO3
CaSiO3+CO2↑ Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
焙烧时铬铁矿发生反应:
4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①应将反应物装在________(填仪器名称)中焙烧;步骤④需要用到的玻璃仪器________________.
(2)步骤③用硫酸将溶液的pH调至7~8,目的是________________;并写出有关的离子方程式________________.
(3)滤液加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为________________.
(4)将红矾钠与KCl固体1∶2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.②③④的实验操作方法分别是________________.

工业上生产红矾(重铬酸钠Na2Cr2O7)的原料为铬铁矿(可视为FeO?Cr2O3、还含有Al2O3、SiO2)。某研究性学习小组模拟工业生产红矾的原理制备红矾,并以红矾为原料制备少量的重铬酸钾(K2Cr2O7)。实验流程为:
已知焙烧时Al2O3、SiO2发生反应:
SiO2+CaCO3![]() CaSiO3+CO2↑ Al2O3+Na2CO3
CaSiO3+CO2↑ Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
焙烧时铬铁矿发生反应:
4FeO?Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①应将反应物装在_______(填仪器名称)中焙烧;步骤④需要用到的玻璃仪器____。
(2)步骤③用硫酸将溶液的pH调至7~8,目的是 ;
并写出有关的离子方程式 。
(3)滤液加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为 。
(4)将红矾钠与KCl固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体。②③④的实验操作方法分别是_______________。
| 序号 | 实验操作方法 | 实验操作过程 |
| ① | 溶解 | 将混合物放入烧杯中,加水,充分搅拌 |
| ② | 将所得溶液沿玻璃棒引流至蒸发皿中,边加热边用玻璃棒搅拌溶液,使NaC1结晶析出 | |
| ③ | 趁热将NaC1晶体与溶液分离 | |
| ④ | 冷却滤液使K2Cr2O7析出 | |
| ⑤ | 过滤 | 得到K2Cr2O7晶体 |
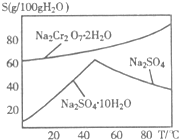 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
| ||
. |
| 温度 | 0℃ | 100℃ |
| 溶解度 | ||
| 物质 | ||
| K2Cr2O7 | 4.6g | 94.1g |
| KCl | 28g | 55g |
| NaCl | 35g | 39g |
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下:
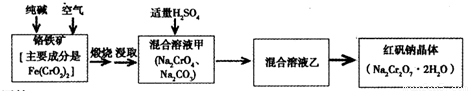
请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是____价。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成____。
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:
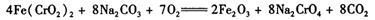
为了加快该反应的反应速率,可采取的措施是____。
(4)已知CrO42—在不同的酸性溶液中有不同的反应,如:

①往混合溶液甲中加入硫酸必须适量的原因是____。
②混合溶液乙中溶质的化学式是____。
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72—必须除去。工业上可用电解法来处理含Cr2O72—的废水,下图为电解装置示意图(电极材料分别为铁和石墨)。通电后,Cr2O72—在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去。
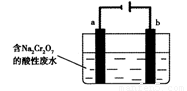
a电极的电极反应式是 ,
b电极附近反应的离子方程式是 。
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业上通过煅烧铬铁矿制取,其反应如下:
反应Ⅰ 4Fe(CrO2)2+8Na2CO3+7O2 → 2Fe2O3+8Na2CrO4+8CO2
反应Ⅱ 2CrO42- + 2H+ → Cr2O72- + H2O
反应Ⅲ 3CrO42- + 4H+ →Cr3O102- + 2H2O(副反应)
(1)上述反应中不属于氧化还原反应有 个。已知Fe(CrO2)2中铬元素是+3价,关于反应Ⅰ的下列说法中正确的是 。
a.被氧化的元素只有+3的Cr,被还原的元素只有0价的O
b.氧化剂与还原剂的物质的量之比为4:7
c.每生成1molCO2,转移3.5mol电子
d.每摩尔+3的Cr能还原0.75mol氧气
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式并标出电子转移的方向和数目: 。
(3)某厂废水中含1.00×10−3mol/L的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入 g FeSO4·7H2O。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com