
题目列表(包括答案和解析)
| NaOH起始读数 | NaOH终点读数 | 第一次 | 0.10mL | 18.40mL | 第二次 | 0.30mL | 18.40mL |
实验是科学探究的重要途径,请完成下列内容:
Ⅰ.某学生的实验报告所列出的下列数据中合理的是_____________。
A.用10mL量筒准确量取7.1mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广范pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
Ⅱ.用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol?L -1的氢氧化钠溶液(指示剂为酚酞)滴定,滴定结果如下:
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 0.30mL | 18.40mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol?L-1 (小数点后保留两位有效数字)。
(2)判断滴定终点的现象是 。
(3)以下操作造成测定结果偏高的原因可能是 (填写序号)。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.滴定前,滴定管下端尖嘴中有气泡存在,滴定终点时气泡消失
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
某研究性学习小组从网上查到绿矾(FeSO4·7H2O)受热分解的方程式为:
2FeSO4·7H2O![]() Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。
Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。
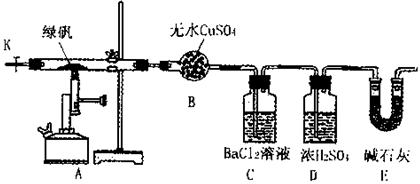
主要实验步骤如下:
①组装仪器并检查装置的气密性;
②称量绿矾样口及U型干燥管E的质量,将称量后的绿矾置于硬质玻璃管内;
③关闭活塞K,加强热使绿矾完全分解;
④打开活塞K,缓缓鼓入一定量的氮气;
⑤再次称量干燥管E的质量;
⑥重复④⑤的操作,直到干燥管E的质量基本不变为止;
⑦称量洗气瓶C中所得沉淀的质量。
试回答:
(1)洗气瓶D中浓H2SO4的作用为: ;
(2)步骤⑦从溶液中获取生成沉淀质量的具体操作为: ;
(3)实验小组的报告如下,请补充完整:
| 实验记录 | 分析或计算结果 | |
| 现象 | 硬质管内绿色变为红棕色; | 生成物有 |
| 干燥管B中晶体白色变蓝色。 | 生成物有H2O | |
| 数据 | 称取绿矾样品16.68g; | 反应的绿矾0.06mol |
| 干燥管E最后增重2.24g; | 生成SO2 mol | |
| C中生成白色沉淀的质量为4.66g; | 生成DO3 0.02mol |
(4)该实验所得到的数据与所样到的化学方程式中的定量关系不相符合,请分析可能的原因。
(5)为达到“验证绿矾受热分解是否发生上述反应”的目的,该实验的设计有多处不妥,请提出改进建议(两条即可)
 Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。
Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。
| | 实验记录 | 分析或计算结果 |
| 现象 | 硬质管内绿色变为红棕色; | 生成物有 |
| 干燥管B中晶体白色变蓝色。 | 生成物有H2O | |
| 数据 | 称取绿矾样品16.68g; | 反应的绿矾0.06mol |
| 干燥管E最后增重2.24g; | 生成SO2 mol | |
| C中生成白色沉淀的质量为4.66g; | 生成DO3 0.02mol |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com