海水中镁的含量一般为1.28g?L
-1,总储量约为2×10
15t,某镁冶炼厂利用海水制镁,其工业流程如下:

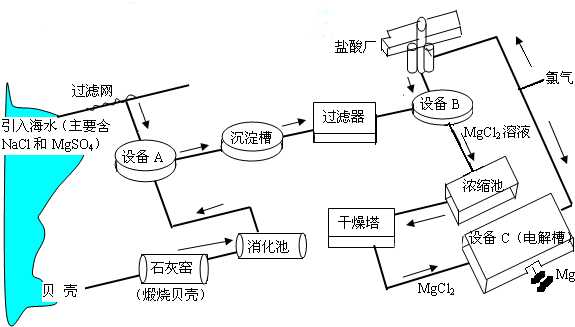
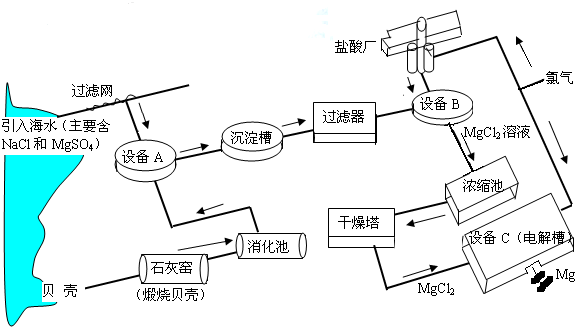
根据上述流程图,回答下列问题:石灰窑中发生反应的化学方程式为
.
消化池中发生的反应CaO+H
2O=Ca(OH)
2,消化池的周围有较多明显的安全警示标志,严禁非专业人员进入,其原因是
氧化钙与水反应放出大量的热,容易灼伤人
氧化钙与水反应放出大量的热,容易灼伤人
;写出设备A和B中反应的化学方程式A:
MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓
MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓
;B:
Mg(OH)2+2HCl═MgCl2+2H2O
Mg(OH)2+2HCl═MgCl2+2H2O
.
设备C中产生的氯气不能排放到空气中,而要循环使用,其原因是:①氯气有毒,排入空气会污染环境;②
氯气可以用来制盐酸节省原料
氯气可以用来制盐酸节省原料
.