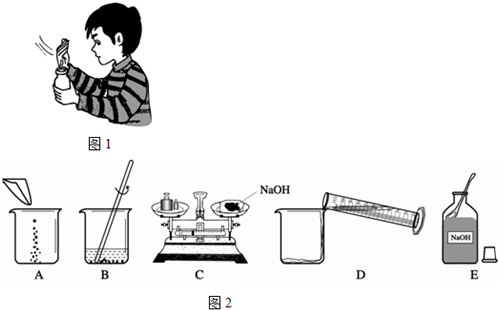
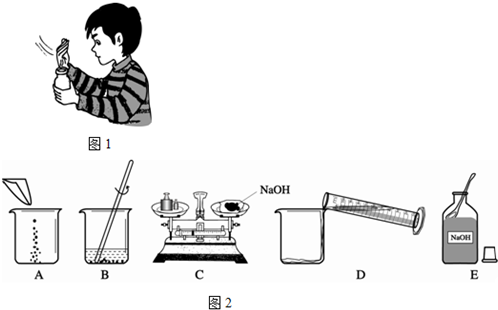
酸、碱、盐是三类重要的化合物.烧碱是氢氧化钠的俗称,它是一种重要的化工原料,广泛应用于肥皂、造纸等工业.
(1)烧碱在工业上通常用电解饱和食盐水的方法制取,产物除烧碱外,还有H
2和Cl
2,请写出电解饱和食盐水的化学方程式
.
(2)烧碱在空气中放置会变质,请你设计一个实验,既能检验烧碱变质的同时,又能除去杂质,用化学方程式表示
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
.
(3)碱和酸有很多共同的特点,如碱与酸都能够发生中和反应,碱与酸都能使酸碱指示剂变色等,请你再写出酸和碱在组成和性质方面的共同点(各写一条)
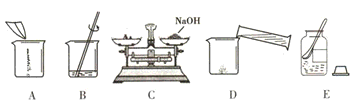
(4)甲同学用固体烧碱和水配置100g 18.5%的NaOH溶液,以下是他在配制烧碱溶液时的操作:
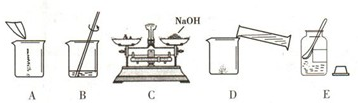
①用图所示的序号表示正确配制该溶液的操作顺序为
ECADB
ECADB
.
②若图C中砝码的质量为15g,游码的读数为3.5g,则小明称得的氢氧化钠质量实际为
11.5
11.5
g.
(5)同学们用pH试纸测定所配制的氢氧化钠溶液的酸碱度,正确的方法是
用玻璃棒将所配制的氢氧化钠溶液滴在pH试纸上,稍停会和标准比色比较,读出溶液的pH
用玻璃棒将所配制的氢氧化钠溶液滴在pH试纸上,稍停会和标准比色比较,读出溶液的pH
.
(6)若8g质量分数为20%的氢氧化钠溶液与22g某盐酸恰好完全中和,试计算反应后所得溶液溶质的质量分数.