
题目列表(包括答案和解析)
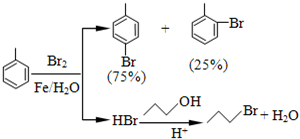
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | |
| 沸点℃ | 110.8 | 97.2 | 71 | |
| 物质 | 对溴甲苯 | 邻溴甲苯 | ||
| 沸点℃ | 184.3 | 181.7 | ||
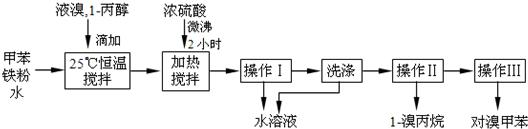
“富煤、贫油、少气”是我国能源发展面临的现状。随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。下图是煤化工产业链之一。
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol–1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ·mol–1 ②
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= _________kJ·mol–1。在标准状况下,33.6 L的煤炭合成气(设全部为CO和H2)与氧气完全反应生成CO2和H2O,反应中转移______mole-。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)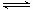 CH3OH(g)
CH3OH(g)
①下列情形能说明上述反应已达到平衡状态的是_______
a.体系压强保持不变
b.密闭容器中CO、H2、CH3OH(g)3种气体共存
c.CH3OH与H2物质的量之比为1:2
d.每消耗1 mol CO的同时生成2molH2
②CO的平衡转化率(α)与温度、压强的关系如图所示。
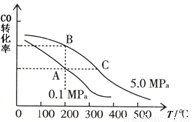
A、B两点的平衡常数_____(填“前者”、“后者”或“一样”)大; 达到A、C两点的平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是_____________(答出两点即可)。
(3)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体为正极燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO + H2-4e- + 2CO32-= 3CO2+H2O;则该电池的正极反应式为____________。
“富煤、贫油、少气”是我国能源发展面临的现状。随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。下图是煤化工产业链之一。
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol–1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ·mol–1 ②
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= _________kJ·mol–1。在标准状况下,33.6 L的煤炭合成气(设全部为CO和H2)与氧气完全反应生成CO2和H2O,反应中转移______mole-。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形能说明上述反应已达到平衡状态的是_______
a.体系压强保持不变
b.密闭容器中CO、H2、CH3OH(g)3种气体共存
c.CH3OH与H2物质的量之比为1:2
d.每消耗1 mol CO的同时生成2molH2
②CO的平衡转化率(α)与温度、压强的关系如图所示。
A、B两点的平衡常数_____(填“前者”、“后者”或“一样”)大;达到A、C两点的平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是_____________(答出两点即可)。
(3)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体为正极燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO + H2-4e- + 2CO32-= 3CO2+H2O;则该电池的正极反应式为____________。

 CH3OH(g)
CH3OH(g)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com