某化学兴趣小组为了探究锌与浓硫酸反应生成气体的成分做了如图实验:
将50g锌粉与50mL浓H
2SO
4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气体,将该气体体积折算成标准状况为11.2L.
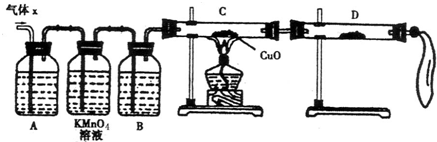
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是
H2
H2
(填分子式).产生这种结果的主要原因是( 用离子方程式表示)
Zn+2H+=Zn2++H2↑
Zn+2H+=Zn2++H2↑
.
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行探究.
①A中加入的试剂可能是
NaOH溶液
NaOH溶液
,作用是
吸收SO2气体
吸收SO2气体
.B中加入的试剂可能是
浓H2SO4
浓H2SO4
.
②证实气体X中混有杂质气体,D中应选择的试剂是
无水CuSO4
无水CuSO4
,同时应观察到C中的实验现象是
黑色固体变红
黑色固体变红
.
(3)理论分析:
①该小组有同学提出只需要再测出一个数据,便能准确的确定该气体的组成,你认为他可以是测下列
BC
BC
.
A、反应后剩余锌的质量为17.5g
B、收集到气体的质量为25.8g
C、浓硫酸的物质的量浓度为18.0mol/L
②根据你在①中所选数据,通过计算确定气体X中各成分物质的量分别为:
SO2为0.4mol,H2为0.1mol
SO2为0.4mol,H2为0.1mol
.

